Facts, Summary & määritelmä
- addukti on additioreaktion muodostama tuote
- Adduktioita voidaan muodostaa vain reaktanteista, joilla on useita sidoksia, kuten alkeenit ja karbonyyliryhmät
- Adduktioita voidaan muodostaa kahden additiotyypin kautta reaktio: elektrofiilinen ja nukleofiilinen
- addukti muodostuu usein Lewis-happojen ja Lewis-emästen välille
mikä on addukti?
addukti on additioreaktion lopussa muodostuva tuote. Tämä on reaktio, jossa kaksi tai useampi molekyyliä reagoi ja yhdistyy muodostaen yhden suuremman tuotteen. Tämän tyyppinen reaktio voi tapahtua vain sellaisten kemiallisten yhdisteiden välillä, joilla on useita sidoksia – yhdisteitä, kuten alkeeneja (kaksoissidoksia) ja alkyynejä (kolmoissidoksia). Myös karbonyyli – (C=O) ja imiiniryhmät (C=n) voivat käydä läpi additioreaktioita ja siten muodostaa adduktioita.
miten adduktioita muodostuu?
kuten aiemmin mainittiin, adduktioita muodostuu additioreaktioiden kautta. Tämän tyyppisessä reaktiossa kaksoissidos katkeaa osittain reagoivan molekyylin hyökätessä ja lisätessä sitä. Alla olevassa reaktiossa tapahtuu eteenin ja bromin välinen additioreaktio.

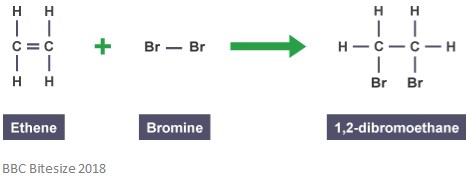
addukti tässä reaktiossa on 1,2-dibromietaani. Tämä johtuu siitä, että se on erillinen laji, joka sisältää kaikkien komponenttien kaikki atomit.
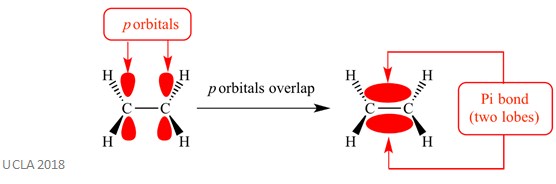
näissä additioreaktioissa on yleensä mukana pi (π) – sidoksia. Tämä on monimutkainen sidostyyppi, jossa vierekkäisten atomien p – orbitaalit menevät päällekkäin-juuri tämä päällekkäisyys aiheuttaa pi-sidoksen. Tämä tapahtuu kohtisuorassa näiden kahden saman atomin välisiä Sigma-sidoksia vastaan. Tällä pi-Bondilla on myös kaksi orbitaalilohkoa – yksi on Sigma-sidoksen tason yläpuolella ja toinen on Sigma-sidoksen tason alapuolella. Pi-bond on esitetty alla olevassa kaaviossa.

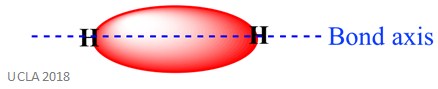
samaan reaktioon voi liittyä myös Sigma (σ) – sidoksia. Tämä on kovalenttisen sidoksen muoto siten, että atomiorbitaalit limittyvät sidosakselia pitkin – toisin sanoen sitä rataa pitkin, joka yhdistää kaksi sidosatomia. Esimerkiksi vetyatomin Sigma-sidos muodostuu kahden 1s-orbitaalin limittymisestä-yksi kustakin vetyatomista. Tämä näkyy paremmin alla olevassa kuvassa-punainen alue, jossa näkyy Sigma bond.

additioreaktiota on kahta päätyyppiä: elektrofiilinen additio ja nukleofiilinen additio.
elektrofiilinen additio
elektrofiilinen additioreaktio on reaktiotyyppi, jossa sidos katkeaa ja muodostuu kaksi uutta sidosta. Kuten aiemmin mainittiin, reaktantilla on oltava kaksois – tai kolmoissidos-elektrofiili lisää pi-sidokseen tässä tapauksessa. Tämä on additioreaktio, joten prosessissa ei häviä mitään – kaikki reaktanttimolekyylien atomit löytyvät myös adduktiosta.

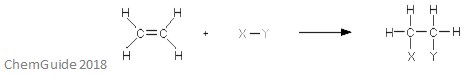
yllä olevassa kuvassa on elektrofiilisen additioreaktion perusarvo. Kuten näette, kaikki reaktanttien atomit löytyvät adduktiosta.
nukleofiilinen additio
nukleofiilinen additioreaktio on reaktiotyyppi, jossa kaksoissidos katkeaa ja muodostuu kaksi yksittäistä sidosta. Elektronipuutteinen (elektrofiilinen) kaksois-tai kolmoissidos reagoi jonkin elektronirikkaan (nukleofiilisen) kanssa. Nukleofiili lisää tässä tapauksessa pi-sidoksen. Alla on esimerkki nukleofiilisesta additioreaktiosta.

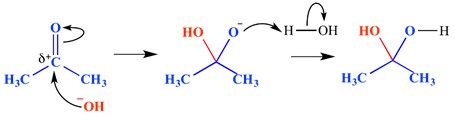
tässä esimerkissä karbonyyliryhmän deltapositiiviseen päähän on lisätty hydroksidi – ioni-tämä on muodostanut oksianionisen tetraedrisen välimolekyylin. Lopputuloksena on siis veden lisääminen karbonyyliryhmän pi-sidoksen yli.
Lewis-happojen ja Lewis-emästen
Adduktien tiedetään usein muodostuvan Lewis-happojen ja Lewis-emästen välille. Muodostunutta molekyyliä kutsutaan Lewis-happo-emäsadduktioksi (tai Lewis-happo-emäskompleksiksi). Koska adduktioita muodostuu vain additioreaktioilla (eli ilman yhtäaikaista ryhmän häviämistä), Lewis-happo-ja Lewis-emäsreaktiot eivät voi olla substituutiotyyppejä.
hyvä esimerkki tästä on THF: n ja BH3: n välinen reaktio, joka näkyy alla olevassa kuvassa. Kuten näette, nämä Lewis-happo-Lewis – emäsadduktit esitetään pisteillä – nämä edustavat elektroneja.

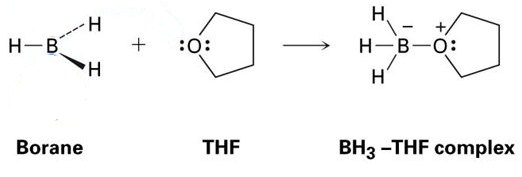
kuten näkyy, ainoa muodostuva tuote on BH3-THF-kompleksi, eli se on addukti.
tämäntyyppisiä reaktioita voidaan kuvata myös nuolilla – nämä nuolet kuvaavat elektronien luovuttamista emäkseltä hapolle. Sama reaktio on esitetty alla, mutta nuolilla osoittamaan elektronien luovutusta.

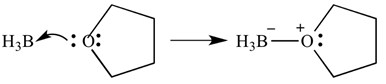
on tärkeää huomata tässä, että näiden nuolien terävässä päässä on kaksi ”väkästä”. Tämä osoittaa, että elektronipari on luovutettu. Jos vain yksi elektroni luovutetaan, nuolen terävässä päässä on vain ”yksi” Bardi.
tässä tapauksessa Lewis-happo on boraani ja Lewis-emäs on THF. Emäs on luovuttanut hapolle yksinäisen elektroniparin muodostaen happi-boori-sidoksen.
yhdisteitä, jotka eivät pysty muodostamaan addukteja molekyylien muodon vuoksi, kutsutaan turhautuneiksi Lewis-pareiksi.
Jatkoluku
http://www.chem.ucla.edu/~harding/IGOC/L/lewis_acid_base_adduct.html