VIVO Patofysiologia
Muut aiheet
Akvaporiinit: vesikanavat
vesi läpäisee solukalvot kahta reittiä: diffuusiolla lipidikaksikon läpi ja vesikanavien kautta, joita kutsutaan akvaporiineiksi. Ensimmäisen akvaporiinin funktionaalinen karakterisointi raportoitiin vuonna 1992, mutta vesikanavien epäiltiin olevan olemassa jo paljon ennen sitä, koska joidenkin epiteelisolujen osmoottinen läpäisevyys oli aivan liian suuri, jotta sitä voitaisiin selittää yksinkertaisella diffuusiolla plasmakalvon läpi.
yksittäinen ihmisen akvaporin-1-kanava helpottaa vesikuljetusta noin 3 miljardin vesimolekyylin sekuntivauhdilla. Tällainen kuljetus vaikuttaa kaksisuuntaiselta vallitsevan osmoottisen gradientin mukaisesti.
klassiset akvaporiinit kuljettavat solukalvojen läpi liukenematonta vettä; ne näyttävät olevan eksklusiivisia vesikanavia eivätkä läpäise kalvoja ioneiksi tai muiksi pieniksi molekyyleiksi. Jotkut akvaporiinit eli akvaglyseroporiinit kuljettavat vettä sekä glyserolia ja muutamia muita pieniä molekyylejä.
Akvaporiinien suku
tähän mennessä on tunnistettu yli 10 eri nisäkäs akvaporiinia, ja lisäjäseniä epäillään olevan. Läheistä sukua olevia vesikanavaproteiineja on eristetty kasveista, hyönteisistä ja bakteereista. Ihmisen punasoluista peräisin oleva akvaporin-1 oli ensimmäinen, joka löydettiin ja on luultavasti parhaiten tutkittu.
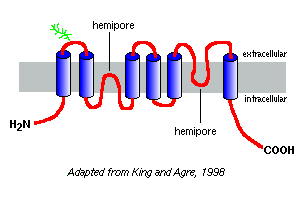
niiden aminohapposekvenssien Hydrofobisuuskäyrät ennustavat, että akvaporiineilla on kuusi kalvoa läpäisevää segmenttiä, jotka on kuvattu akvaporin-1: n mallissa oikealla.
akvaporiini-1: llä tehtyjen tutkimusten perusteella näyttää siltä, että akvaporiineja esiintyy plasman kalvossa homotetrameereina. Jokaisessa akvaporiinimonomeerissa on kaksi hemihuokosta, jotka taittuvat yhteen muodostaen vesikanavan.
eri akvaporiineilla on erilaiset glykosylaatiomallit. Akvaporin-1: n tapauksessa peptidin selkäranka on noin 28 kDa ja glykosyloidut muodot vaihtelevat massaltaan 40-60 kDa. Useimmilla akvaporiineilla on proteiinikinaasi A: n fosforylaatiomotiivi yhdessä sytoplasmasilmukoissa, ja differentiaalisen fosforylaation epäillään empartoivan molekyylille säätelyfunktiota.
Akvaporiinin Ilmentymäkuviot
kullakin akvaporiinilla on oleellisesti ainutlaatuinen ilmentymäkuvio kudosten keskuudessa ja kehityksen aikana. Yhteenveto näistä ominaisuuksista ja joistakin merkittävistä potentiaaleista tai tunnetuista funktioista on esitetty seuraavassa taulukossa:
| tärkeimmät Ilmentymispaikat | ||
|---|---|---|
| Akvaporin-0 | silmä: linssin kuitusolut | nestetasapaino linssin sisällä |
| akvaporin-1 | punasolut | osmoottinen suoja |
| munuaiset: proximal tubule | Concentration of urine | Eye: ciliary epithelium | Production of aqueous humor | Brain: choriod plexus | Production of cerebrospinal fluid | Lung: alveolar epithelial cells | Alveolar hydration state |
| Aquaporin-2 | Kidney: collecting ducts | Mediates antidiuretic hormone activity |
| Aquaporin-3 * | Kidney: collecting ducts | Reabsorbtion of water into blood |
| Trachea: epiteelisolut | veden eritys henkitorveen | |
| Akvaporin-4 | munuainen: keräyskanavat | veden uudelleensyntyminen |
| aivot: ependymaalisolut | CSF nestetasapaino | |
| aivot: hypotalamus | Osmosensoiva toiminto? | |
| keuhko: keuhkoputken epiteeli | keuhkoputken nesteen eritys | |
| Akvaporin-5 | sylkirauhasten eritys | syljen eritys |
| Kyynelrauhasten tuotanto | ||
| Akvaporin-6 | munuainen | hyvin alhainen vedenläpäisevyys; toiminta? |
| Akvaporin-7 * | rasvasolut | kuljettavat glyserolia ulos adiposyyteistä |
| kivekset ja siittiöt | ||
| Akvaporin-8 | kives, haima, maksa, muut | |
| akvaporin-9 * | valkosolut | |
| * akvaglyseroporin | ||
pitäisi olla selvää, että akvaporiinit ovat hyvin laajalle levinneitä, ja myös se, että eri akvaporiineilla on erilaisia toiminnallisesti tärkeitä erikoisuuksia.
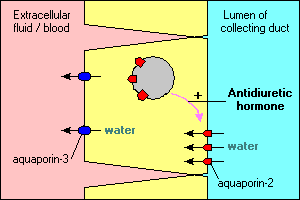
useita mielenkiintoisia ja tärkeitä akvaporiinivälitteisen vesikuljetuksen piirteitä havainnollistetaan munuaisen keräyskanavia linjaavissa pääsoluissa. Näiden kanavien läpi virtaava vesi voi joko jatkaa matkaansa ja erittyä virtsaan tai imeytyä uudelleen epiteelin poikki ja takaisin vereen. Reabsorptio on periaatteessa nolla, elleivät epiteelisolut näe antidiureettista hormonia, joka stimuloi voimakkaasti veden takaisinimeytymistä. Keräävissä kanavasoluissa on vähintään kaksi akvaporia:
- Akvaporin-2 on syntetisoitu, mutta antidiureettisen hormonin poissaolossa se asuu solukalvorakkuloiden altaassa sytoplasmassa. Antidiureettisen hormonin sitoutuminen sen reseptoriin solussa ei ainoastaan stimuloi akvaporin-2-geenin transkriptiota, vaan aiheuttaa akvaporin-2: n solunsisäisen poolin tunkeutumisen apikaaliseen kalvoon. Solu pystyy nyt ottamaan tehokkaasti vettä kanavan luumenista.
- Akvaporin-3 ilmaistaan konstitutiivisesti solun basolateraalisessa kalvossa. Kun vesi tulvii soluun aquaporin-2-kanavien kautta, se voi nopeasti poistua solusta aquaporin-3-kanavien kautta ja virrata vereen.
Akvaporiinit ja tauti
ottaen huomioon vesiliikenteen merkityksen lukemattomissa fysiologisissa prosesseissa on oletettavaa, että akvaporiinigeenien leesiot tai akvaporiinien hankitut toimintahäiriöt voivat aiheuttaa tai myötävaikuttaa useisiin tautitiloihin. Tällaisten yhteyksien etsintä on vielä alkuvaiheessa, mutta akvaporiinien puutoksesta johtuviksi taudeiksi on todettu kaksi selvää esimerkkiä:
- Akvaporin-2-geenin mutaatiot aiheuttavat ihmisellä perinnöllisen nefrogeenisen diabeteksen insipiduksen.
- akvaporin-0-geenin inaktivoiviin mutaatioihin homotsygooteilla hiirillä kehittyy synnynnäinen kaihi.
- aikuisiän lihavuus kehittyy hiirillä homotsygoottina akvaporin-7-geenin inaktivoiviin mutaatioihin, mikä johtuu oletettavasti tehottomuudesta glyserolin kuljettamisessa hydrolysoiduista triglyseridivarastoista.
pienellä joukolla on todettu vakava tai täydellinen akvaporin-1-puutos. On mielenkiintoista, että ne näyttävät kliinisesti vahingoittumattomilta, mutta niitä ei ole tutkittu vedenpuutteen olosuhteissa. Hiiret, joilla on kohdennettuja poistoja aquaporin-1: ssä, näyttävät myös normaaleilta ja terveiltä, ellei niillä ole nestevajausta, jolloin niistä tulee vakavasti hyperosmolaarisia.
viitteet ja arvostelut
- Borgnia M, Nielsen S, Engel a, Agre P: Akvaporin vesikanavien Cellular and molecular biology. 68: 425, 1999.
- deGroot BL, Grubmuller H: Water permeation across biological membranes: Mechanism and dynamics of aquaporin-1 and GlpF. Tiede 294:2353, 2001.
- Hibuse T, Proc Nat Acad Sci (USA) 102:10993, 2005.
- kuningas LS, Agre P: akvaporin vesikanavien Patofysiologia. Annu Rev Physiol 58: 619, 1998.
- Knepper MA, Inoue T: Regulation of aquaporin-2 water channel traffic by vasopressin. Curr Opinion Cell Biol 9: 560, 1997.
- Lee MD, King LS, Agre P: the aquaporin family of water channel proteins in clinical medicine. Lääketiede 76:141, 1997.
- Preston GM, Carroll TP, Guggino WP Agre P: esiintyminen Vesikanavissa Xenopus-varhaismunasoluissa, jotka ilmentävät punasolujen CHIP28-proteiinia. Tiede 256:385, 1992.
- Sasaki S, Ishibashi K, Marumo F: Aquaporin-2 ja -3: kahden akvaporiiniperheen alaryhmän edustajat kolokalisoituivat munuaisten keräyskanavaan. Annu Rev Physiol 60:199, 1998.