Biomaterials
biomateriaalien tutkimusta on mahdollista rajata hyvin yleisellä, mutta johdonmukaisella puiston ja järvien määrittelyllä . Niiden mukaan biomateriaaliksi voidaan määritellä mikä tahansa materiaali, jota käytetään sellaisten laitteiden valmistuksessa, joilla korvataan kehon osa tai toiminta turvallisella, luotettavalla, taloudellisella ja fysiologisesti hyväksyttävällä tavalla.
jotta implantin rakenne voidaan korvata, suurentaa tai tukea tyydyttävästi, sen on matkittava kudoksen ominaisuuksia tai vastattava niitä. Kirjallisuudessa kerrotaan, että implanteissa käytetään erityyppisiä luusiirrännäisiä: autologisia (samasta yksilöstä peräisin olevia), homologisia (samaa vastaanottajalajia olevasta yksilöstä) ja heterologisia (kun luovuttajan ja vastaanottajan lajit eivät ole sama – esimerkiksi karja ).
Autologisilla grafteilla on tiettyjä haittoja, esimerkiksi: toimenpide potilaan kehon terveellä alueella; luovuttajan alueen sairastuvuus, korkeampi toipumisaika; alttius infektioille; ja progressiivinen ja jatkuva resorptio . Niinpä synteettisten biomateriaalien, kuten keramiikan ja polymeerien, implantteja on kehitetty ja sovellettu laajalti. Pereiran, Buonon ja Zavaglian mukaan biomateriaalien kysyntä on kasvanut vuosittain 5-15 prosenttia.
biomateriaalien luokitus
Bathin ja Santosin mukaan biomateriaalit voidaan luokitella neljään luokkaan sen mukaan , miten yhteensopivia ne ovat ympäröivien kudosten kanssa:
Biotolerantti: implantti, joka erotetaan ympäröivästä luusta rajapinnan päällä olevalla pehmytkudoskerroksella. Ei kontaktia osteogeneesissä. Kerros indusoituu monomeerien, ionien ja/tai korroosiotuotteiden implanttipurkauksesta. Lähes kaikki synteettiset polymeerit ja useimmat metallit kuuluvat tähän luokkaan.
Bioinert: Implantit ovat suorassa kosketuksessa luukudokseen, ja ne osallistuvat osteogeneesiin. Kudoksen ja implantin välillä ei kuitenkaan ole kemiallista reaktiota. Mitään komponenttia ei vapaudu ainakaan solujen havaitsemissa määrissä. Esimerkkejä bioinert biomateriaalien ovat: alumiinioksidi, Zirkonia, titaani, tantaali, niobium ja hiili.
bioaktiivinen: implantin ja luukudoksen välinen vuorovaikutus häiritsee suoraan osteogeneesiä. Kemiallisen samankaltaisuuden kautta luukudoksen mineraaliosa sitoutuu implanttiin edistäen osteokonduktiota. Tämän luokan tärkeimmät materiaalit ovat: Ca-fosfaatti, vitro-keramiikka ja hydroksiapatiitti.
Bioresorboitavissa: aineet, jotka tietyn ajan kudosten kanssa kosketuksiin joutuessaan päätyvät hajoamaan, liukoistumaan tai fagosytoitumaan elimistöön. Ne ovat kiinnostavia kliinisissä sovelluksissa, joissa implantaatin uudelleen avaaminen ei ole suositeltavaa. Tämän luokan edustajia ovat trikalsiumfosfaatti (TCP) ja plla (poly-L-maitohappo).
metalliset biomateriaalit
joskus elimistö sietää metallisia alkuaineita luonnollisessa muodossaan ja pieninä määrinä, kuten rautaa (Fe) punasoluissa, kobolttia (Co) B12-vitamiinin synteesissä ja aortan valtimossa olevan elastiinin ristisidoksissa . Elimistö ei kuitenkaan siedä suuria määriä useimpia metalleja.
joitakin metalleja käytetään kovien kudosten korvikkeina esimerkiksi lonkka-ja polviproteeseissa, murtumien kiinnittämiseen tarkoitetuissa levyissä ja ruuveissa, pylvään kiinnityslaitteissa ja hammasimplanteissa niiden erinomaisten mekaanisten ominaisuuksien ja korroosionkestävyyden vuoksi . Barbuccin mukaan ortopedisten proteesien , osteosynteesilaitteiden ja hammasimplanttien rakentamisessa käytettävällä metallimateriaalilla tulee olla seuraavat ominaisuudet:
- Rajakestävyys vähintään 800 MPa;
- korroosionkestävyys (paikallinen ja yleinen);
- bioyhteensopivuus.
bioyhteensopivuus ei ole ilmiö tai ainutlaatuinen ilmiö. Sillä tarkoitetaan useita prosesseja, joissa on erilaisia vuorovaikutusmekanismeja, mutta jotka ovat toisistaan riippuvaisia materiaalien ja kudosten suhteen. Se on materiaalin kyky suorittaa tietty tehtävä kehossa aiheuttamatta myrkyllisiä tai vahingollisia vaikutuksia biologisiin järjestelmiin .
nämä ominaisuudet ovat niin rajoittavia, että vain pieni määrä metallisten materiaalien luokkia voidaan onnistuneesti käyttää.
ensimmäinen erityisesti ihmiskehon käyttöön kehitetty seos oli ”vanadiiniteräs”, jota käytettiin luunmurtumien levyjen ja ruuvien valmistukseen . Metallisista biomateriaaleista yleisimmin käytettyjä ovat austeniittiset ruostumattomat teräkset tyyppiä 316 LVM, seokset Co-Cr-Mo, Co-Ni-Cr-Mo, puhdas titaani ja Ti-6Al-4V . Joitakin esimerkkejä on esitetty kuvassa 1.

Kuva 1: lääketieteelliset laitteet: a) reisiluun pää; b) superior artikulaatiopolvi; c) Alaleukalevy.
tässä teoksessa käsitellään tarkemmin seoksia Co ja Ti, joiden soveltaminen dmls: n nopeassa prototyypityksessä lääketieteen alalla on ilmeikkäämpää.
Kobolttiseoksia
Kobolttiseoksia ehdotettiin alun perin kirurgisiin implantteihin yli 70 vuotta sitten . On periaatteessa kahdenlaisia Co seokset lääketieteelliseen käyttöön. Metalliseos Co-Cr-Mo pinnoitukseen ja työstetyt seokset Co-Ni-Cr-Mo . American Society for Testing and Materials (ASTM) listaa neljä Co-seoksia, joita suositellaan käytettäväksi kirurgisissa implanteissa: Co-Cr-Mo (F75) ja worked alloys Co-Cr-W-Ni (F90), Co-Ni-Cr-Mo (F562) ja Co-Cr-Mo (F1537).
nämä seokset ovat materiaaliluokka, joka kestää erittäin hyvin korroosiota fysiologisissa ympäristöissä ja kulumista, mikä ylittää ruostumattoman teräksen . Lisäksi sen ylivoimainen resistanssiraja ja väsymiskestävyys mahdollistavat sen soveltamisen, jos pitkä käyttöikä ilman murtumien tai rasituksen/väsymyksen esiintymistä on tarpeen . Monet ominaisuudet ovat peräisin koboltin kristallografisesta luonteesta, CR: n ja Mo: n tehostevaikutuksesta ja karbidien korkean kovuuden muodostumisesta .
tällaiset erityisominaisuudet ovat johtaneet näiden seosten käyttöön erilaisissa lääketieteellisissä sovelluksissa, erityisesti niissä, joissa pyritään korvaamaan nivelpintoja. Niiden kulutuskestävyys, korroosio ja alhainen kitkakerroin ovat ratkaisevia tässä valinnassa.
esimerkkinä käyttökohteesta on koko lonkan Artroplastia (THA). Uudemmat järjestelmät koostuvat reisitangosta, joka on kiinnitetty modulaariseen päähän ja joka koordinoituu asetabulaarisen komponentin kanssa . Tämä järjestelmä tunnetaan nimellä MoM (Metalli Metalli) – suhteessa kosketuspinnan – ja on parempi kuin MoP (metalli polyeteeni) järjestelmiä, käytetään suhteessa tilavuusnopeuden kulumisen ja muiden parametrien toistaiseksi, kuten raportoitu . Kuvassa 2 on esimerkki Tha: n MOP-ja MoM-järjestelmistä.

kuva 2: vasemmalla: MoP; oikealla: Äiti.
toinen esimerkki Kooseosten käytöstä, johon tämä työ liittyy suoraan, on temporomandibulaarisen nivelen kokonaisrekonstruktio. Tämäntyyppinen proteesi, joka tunnetaan nimellä Christensen proteesi, on ollut käytössä yli 30 vuotta, ja sille on ominaista vakaan, luotettavan ja ennustettavan jälleenrakentamisen edistäminen, joka tarjoaa kivun tason vähentämisen, toiminnallisuuden parantamisen ja suuremman liikkuvuuden . Kuva 3 kuvaa temporomandibulaarista proteesia.
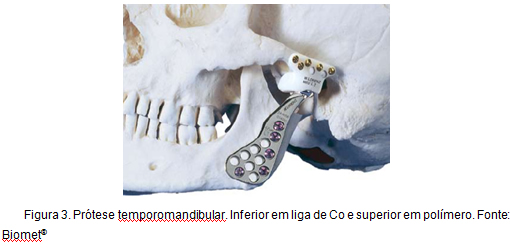
kuva 3: temporomandibulaarinen proteesi.
Titaaniseokset
brittiläisen mineralogin William Gregorin vuonna 1791 löytämää titaania – ja viime aikoina sen seoksia – on käytetty vuosikymmenien ajan murtumien kiinnittämiseen ja nivelten rekonstruktioon, koska se täyttää biolääketieteellisissä sovelluksissa, kuten: kulutuskestävyys, bioyhteensopivuus, bioadhesion (luun kasvun induktio), kimmomoduuli (mitä lähempänä ihmisen luuta – 10-30 GPa -, sitä parempi), väsymiskestävyys ja hyvä prosessoitavuus,.
titaanilla on alfa-faasiin liittyvä heksagonaalinen umpipakattu (hcp) rakenne, joka voi käydä läpi allotrooppisen muutoksen 881ºc: ssa beetafaasina tunnetulle runkokeskiselle kuutiolliselle (BCC) rakenteelle. Näiden kristallografisten ominaisuuksien manipulointi lisäämällä sideaineita ja termomekaanisia prosesseja mahdollistaa erilaisten ominaisuuksien omaavien seosten saamisen.
titaaniluokat, jotka alun perin otettiin käyttöön biomateriaaleina, olivat ASTM F67 (kaupallisesti puhdas titaani luokissa 1, 2, 3 ja 4), ASTM F136 (metalliseos Ti-6Al-4V Extra Low Interstitial) ja ASTM F1472 (metalliseos Ti-6Al 4W-standardi) . Näissä materiaaleissa jotkut seosaineet vakauttavat alfa-vaiheen, kun taas toiset vakauttavat beeta-vaiheen. Yksi vakauttaa alfa-vaihe sisällyttämällä alumiini, Tina, ja zirkonium, kun taas beta-vaihe voidaan vakauttaa vanadiini, molybdeeni, niobium, kromi, rauta, ja mangaani . On siis huomattava, että seos ASTM F136 on esimerkki stabiloidusta alfa / beeta-seoksesta.
osa titaanissa ja sen seoksissa havaitusta kulutuskestävyydestä johtuu pääasiassa TiO2: sta koostuvan passiivisen oksidikerroksen muodostumisesta, joka kiinnittyy metallin pintaan ja suojaa sitä, minkä lisäksi se on suurelta osin vastuussa materiaalin bioyhteensopivuudesta. Tämä kerros voidaan saada anodisella hapetuksella etikkahapon elektrolyytissä, ja kun titaanin läsnäoloa implantin viereisessä kudoksessa arvioidaan, se on huomattavasti pienempi anodisoidussa implantissa verrattuna niihin, joissa ei ole pinnan anodisointia,.
vakava trauma kasvojen rakenteessa vaatii suuren määrän levyjä ja ruuveja, ja titaani-implantit ovat erityisen sopivia tässä katsauksessa mainittujen ominaisuuksien vuoksi. Kranio-maxillofacial-alueelle on olemassa levyjä ja ruuveja eri kokoonpanoissa, jotta lääkäri voi säätää järjestelmän potilaan anatomian mukaiseksi. Kuva 4 on esimerkki titaanin käytöstä kranio-leukamurtumien kiinnityksessä.

Kuva 4: kallon ja leukamurtumien kiinnityslevyt.
toinen käyttökohde , joka osoittaa materiaalin monipuolisuuden, esiintyy intramedullaarisissa sauvoissa sääriluun umpeutumisen ja avomurtuman osalta, jossa implantti (kuva 5) on tarkoitettu suurempien luunmurtumien ja isompien mekaanisten rasitusten (sääriluun) vuoksi.
kuva 5: sääriluun intramedullaarinen akseli ti.
Keraamiset biomateriaalit
biolääketieteellisiin sovelluksiin tarkoitettujen keraamisten materiaalien kehittäminen keskittyy lähinnä ortopedian ja hammaslääketieteen aloille . Se on materiaaliluokka, joka sisältää useita biomateriaalien ominaisuuksia. Siinä on bio-inertin, bioresorboituvan, bioaktiivisen ja huokoisen kudoksen kasvun luokkien edustajia .
keramiikan potentiaali biomateriaalina johtuu sen samankaltaisuudesta fysiologisen ympäristön kanssa, johtuen sen perusrakenteesta ioneista, joita esiintyy myös fysiologisessa ympäristössä (kalsium, kalium, magnesium, natrium jne.) ja muut, joiden myrkyllisyys on hyvin rajallinen (zirkonium ja titaani).
bio-inertti keramiikka on edustavampaa alumiinioksidin (Al2O3), zirkonian (ZrO2) ja yttriumoksidilla stabiloidun Zirkonin (ZrO2 (Y2O3)) yhdisteissä. Niiden kyky reagoida ympäröivään kudokseen, korroosionkestävyys, korkea kulutuskestävyys ja korkea mekaaninen kestävyys ovat olennaisia ominaisuuksia niiden käytössä nivellettävinä pinnoina, jotka altistuvat kuormituksille ja kitkalle .
bioaktiivisen ja bioresorboituvan keramiikan ytimestä löytyy yhdisteitä, kuten hydroksiapatiittia (HA), kalsiumfosfaatteja, erityisesti β-trikalsiumfosfaattia (β-TCP), sekä bioglasseja ja lasikeramiikkaa, joiden koostumus koostuu laajasta oksideista (SiO2, P2O5, CaO, CaF2, Na2O, Al2O3, Ta2O5, ja muun muassa tio2.) .
Park, J; Lakes, R. S. ”Biomaterials – An Introduction”. Springer. 3 edição. 2007. s.2.
gália, C. A; et al. ”Use of homologous and heterologous graft in femoral diaphysis of rats: comparison between Frozen and lyophilised bone graft”. Brazilian Journal of Orthopedia and Traumatology. Maaliskuuta 2005.
Marzola, C; Toledo Filho, J. L. ”fundamentals of Oral Maxillofacial Surgery-implants of alloplastic materials”” Chapter X.
Pereira, M. m; Buono, V. T. L; Zavaglia, C. A. C. ” Metallic Materials: Science and application as biomaterials. Julkaisussa: Orefice, R. A; Pereira, M. M; Mansur ,H. S. ”Biomaterials: fundamentals and applications”” Rio de Janeiro. Lääketieteellinen kulttuuri, 2006, luku. 2, s. 39-58.
Bath, S. V. ”Biomaterials”. Narosa-Kustantamo. Nova Dheli, Intia. 2002. s. 181
Santos, L. A. ” Development of calcium phosphate reforçado por fibras para uso na área médico-odontológica.”Tese de Doutorado. Campinasin osavaltionyliopisto. 2002.
Wong, J. Y; Bronzinho, J. D. ”Biomaterials”. Taylorin ja Francisin ryhmä. – Kyllä. 2007. S. 1-1.
Barbucci, R. ”Integrated Biomateriais Science”. Kluwer Academic / Plenum Publishers. New Yorkissa.2002. kaveri.6. s. 289-290.
Bertol, L. S. ”Contribution to the study of rapid prototyping, three-dimensional digitization and material selection in the design of custom implants”” Master ’ s dissertation. Rio Grande do Sulin liittovaltion yliopisto. Porto Alegre. 2008.
Donachie M. ”Metals Handbook desk Edition”. 2. Painos, toimittanut Davis, J. R. ASM International. 1998.
Disegi, J. A; Kennedy, R. L; Pilliar, R. ”Cobalt-Base Alloys for biolääketieteen Application”. ASTM-STP 1365. 1999.
Shi, D. ”Introduction to Biomaterials”. Tsinghua University Press, World Scientific. 2006. p – 123.
Marti, A. ”Cobalt-base alloys used in bone surgery”. Loukkaantuminen-International Journal of the care of the Injured. 2000 (31).
wnek, G. E; Bowlin, G. L. ”Encyclopedia of Biomaterials and Biomedical Engineering”. Vol 2. 2 edição. Informa Healthcare. 2008.
Sieber, H. P; Rieker, C. B; Köttig, P. ”Analysis of 118 second-generation metal-on-metal retrieved hip implants”. Journal of Bone & Joint Surgery (Br). 1998; 80-B: 46-50.
Garret, W. R; Abbey, P. A; Christensen, R. ”Temporomandibular joint reconstruction with a custom total temporomandibular joint protees: Use in the multiply operated patient”. Uusintapainos teoksesta Surgical Technology International vi.
Leyens, C; Manfred, P. ”Titanium and Titanium alloys: fundamentals and applications”. Wiley-VCH. Ensipainos. 2003. p – 1.
Yaszemski, M. J; Tantrolo, D. J; Lewandrowski, K; Hasirci, V; Altobelli, D. E; Wise, D. L. ”Biomaterials in orthopedics”. Marcel Dekker Inc. 2004. p-2.
lütjering, G; Williams, J. C. ”Titanium – Engineering Materials and Processes. Springer-Verlag. Toinen painos. 2003. p – 399.
Brown, S. A; Lemons, J. E. ”Medical applications of titanium and its alloys: the material and biological issues”. Proceedings of a symposium järjestettiin vuonna 1994 Phoenixissa Arizonassa. STP 1272. ASTM. 1996.
Brunette, D. M; Tengvall, P; Textor, M; Thomsen, P. ”Titanium in medicine: material science, surface science, engineering, biological responses and medical applications”. Springer-Verlag. 2001. p – 28.
Larsson, C; Thomsen, P; Aronsson, B. O; Rodahl, M; Lausmaa, J; Kasemo, B; Ericson, L. E. ”Bone response to surface-modified titanium implants: studies on the early tissue response to machined and electropolished implants with different oxide thicknesses”. Biomaterias 17 (1996) 605-616. Elsevier .
Jorgenson D. s; Centeno, J. A; Mayer M. H; Topper, M. J; Nossov, P. C; Mullick, F. G; Manson, P. N. ”Biologic response to passive dissolution of titanium craniofacial microplates”. Biomaterials 20 (1999) 675-682. Elsevier.
Zimmer Sirus® – Intramedullary Nail System. Zimmer, 2007.
Shakelford, J. F. ”Bioceramics-Advanced ceramics; v. 1”. Gordon ja Breach Science Publishers, 1999. p-5.
Hench, L. L. ”Bioceramics: from concept to Clinic”. J. Am. Keraamia. Soc., 74 (7) 1487-510 (1991).
Hench, L. L; Wilson, J. ”an introduction to Bioceramics”. World Scientific Publishing Co, 1993. p – 25.
Bubok, V. A. ”Bioceramics – Yesterday, Today, Tomorrow”. Jauhemetallurgia ja Metallikeramiikka, Vol. 39, nro 7-8, 2000.
Muokattavat proteesit
kranio-maxillofacial rekonstruointi nopealla prototyyppauksella
Nopea prototyyppaus on tekniikka, jossa osia valmistetaan additiivisella menetelmällä. CAD-järjestelmässä luotu 3D-malli jaetaan 2D-profiileihin, jotka sitten rakennetaan nopealla prototyyppilaitteistolla kerros kerrokselta. Useita tekniikoita on saatavilla tänään, kuten: stereolitografia (SLA), suora metalli Laser sintraus (DMLS), Laser pinta sulanut (LSM), fuusioitu laskeuman mallinnus (FDM), 3D-tulostus (3DP) ja Elektronisuihkuhitsaus (EBW) .
dmls-tekniikan ensimmäisen vuosikymmenen aikana, vuosina 1994-2004, sitä hallitsivat ainakin kaupallisissa sovelluksissaan erityisesti dmls-prosessia varten kehitetyt materiaalit, jotka keskittyivät prosessoitavuuden ja yleisimmille sovelluksille hyväksyttävien ominaisuuksien parantamiseen. Nykyään dmls: ssä on käytettävissä monenlaisia seoksia, kuten kevyitä titaaniseoksia. Erityistä kiinnostusta lääketieteen alalla ovat Ti-6Al-4V-titaani, alumiini, vanadiini ja ticp-kaupallisesti puhdasta titaania. Molemmille on ominaista niiden erinomaiset mekaaniset ominaisuudet, korroosionkestävyys, alhainen ominaispaino ja erityisesti sen biologinen yhteensopivuus .
perinteisesti teollisuudessa ja konepajateollisuudessa käytetään nopeaa prototyyppien valmistusta keinona tuottaa luotettavia prototyyppejä lyhyessä ajassa, mikä tuo kustannushyötyjä . Viime aikoina RP on laajentanut sovellustaan insinöörituotteiden ulkopuolelle. Sen käyttö lääketieteen alalla valmistukseen mukautettuja implanttien ja proteesien, tutkimus anatomia, ja kirurginen suunnittelu ovat tärkeitä tutkimusaloja . Lääketieteen alaa koskevalla valituksella on edessään merkittäviä esteitä, kuten se, että tapaukset eivät ole koskaan keskenään tasavertaisia – minkä vuoksi implanttien tuotannon standardointi ei ole edullista – ja kirurgian alueen hämäriin kohtiin liittyvät kysymykset vaikeuttavat kirurgian suunnittelua .
synnynnäisistä vioista kraniofacial anomaliat (CFA) ovat hyvin monimuotoinen ja monimutkainen ryhmä, joka vaikuttaa merkittävään osaan maailman ihmisistä .
synnynnäisten epämuodostumien lisäksi on muiden häiriöiden – esimerkiksi kasvainten-takia hankittuja kraniofasiaalivirheitä. Neljän viime vuosikymmenen aikana on havaittu myös kasvovammatapausten määrän kasvua, mikä liittyy läheisesti auto-onnettomuuksien ja kaupunkiväkivallan lisääntymiseen.
kaikissa tapauksissa kallon ja leukaluun kuntoutus on osa potilaiden yhteiskuntaan sopeuttamista ja hyvinvoinnin edistämistä.
Nopea prototyyppaus kallon ja kasvojen rekonstruktiossa
tavanomainen keino valmistaa implantti kallon vian korjaamiseksi on implantin suora mallinnus leikkauskohdassa leikkauksen aikana. Painatus tehdään vahalla ja sitä käytetään myöhemmin biomateriaalimuotin valmistuksessa . 1980-luvun lopulla ilmestyivät ensimmäisen tutkimuksen tulokset, jossa yritettiin löytää tapa tuottaa fyysinen malli suoraan digitaalisesta kolmiulotteisesta mallista .
Nopea prototyyppaus on valmistustapa kerros kerrokselta, jolla voidaan tuottaa monimutkaista geometriaa CAD-mallista .
sen käyttö lääketieteellisissä sovelluksissa on mullistanut monimutkaisten leikkausten suunnittelun rakentamalla ennen leikkausta anatomisia malleja, joiden avulla hoitohenkilökunta voi arvioida kriittisesti jokaisen erityistapauksen . Se on myös saanut paljon painoa sen käytöstä räätälöidyssä valmistuksessa implantit jälleenrakentamiseen kallo ja kasvojen puutteita , , , , .
räätälöityjen implanttien rakentamisessa tarvitaan potilastietojen syöttämistä. Tiedot saadaan CT: stä tai NMRI: stä 2D-poikittaisviipaleina DICOM-muodossa, jonka paksuus määritetään laitteista kuvia hankittaessa. Viipaleiden määrä ratkaisee kuvan resoluution ja sitä kautta 3D-mallin. 2D-viipaleet siirretään lääketieteelliseen mallinnusohjelmaan, jossa on mahdollista säätää kynnyssignaalia, jotta saadaan interpoloinnin jälkeen luuston rakenteen 3D-esitys .
mallin saamisen jälkeen se voidaan käsitellä CAD-ohjelmistolla, jolla voidaan mallintaa luustovikaa korjaava implantti.
kuvioitu kiinteä aine muunnetaan tämän jälkeen STL-muotoon ja se voidaan prototyyppiä millä tahansa nopealla prototyyppitekniikalla.
viimeaikaisissa sovelluksissa, materiaaleissa ja tapausraporteissa
kallon ja leukaluun korjausalueella on raportoitu useita tapauksia, joissa on onnistuttu soveltamaan 3D-mallinnustekniikoita ja prototyyppejä räätälöidyille implanteille.
Bertol et al. raportoitu käyttö tomografia kuvia saada 3D virtuaalinen malli virtuaalinen resektio menettely osa leuan vaikuttaa kasvain ja myöhemmin implantti suunnittelu korvata teennäinen tekniikka peilaus tason symmetria, jossa terve osa leuan on peilattu ja käytetään jälleenrakentamiseen poistetun alueen.
Kuva 7: 3d-mallin ja implantin Obtainment-prosessi (vasemmalla). Dmls: n rakentama implantti (oikealla).
implantti rakennettiin titaanista (Ti-6Al-4V) käyttämällä suoraa Metallilasersintraustekniikkaa (DMLS). Tässä prosessissa jauhemainen metalli sulatetaan kiinteäksi osaksi paikallisen sulamisen kautta, jonka tarjoaa tietokoneen ohjaama suurienerginen lasersäde osan rakenteen mukaan.
implantin valmistamisen jälkeen se skannattiin 3D-skannaustekniikalla ulottuvuusvertailua varten virtuaalimalliin. Erot eivät olleet suurempia kuin 0,05 mm, mikä osoittaa menetelmän tarkkuuden.
Drstvensek ym.raportoivat myös onnistuneita tapauksia, jotka osoittavat nopean prototyyppien suuren potentiaalin lääketieteen alalla. Yhdessä ilmoitetussa tapauksessa hoidettiin vakavaa kasvojen epäsymmetriaa (hemifacial microsomia). Käytetty menetelmä oli samanlainen kuin bertol et al. 3D-mallit saatiin CT-kuvista ja implantti kehitettiin virtuaaliympäristössä peilaamalla ehjä osa.
Kuva 8: rakennettavan alueen virtuaalinen malli (vasemmalla); Dmls: n valmistama implantti .
toisessa drstvensekin ym.raportoimassa tapauksessa käytettiin samoja tekniikoita kalloimplantin valmistuksessa ja posteriorisessa 3D-skannauksessa mittakontrollia varten. Virtuaalimalliin verrattuna implantti osoitti joillakin alueilla 0,8-1,0 mm: n vaihtelua. Kirjoittajan mukaan implantti hyväksyttiin ja toteutettiin onnistuneesti, koska kyseinen alue ei sijaitse kriittisessä osassa. Molemmissa tapauksissa käytetty prototyyppitekniikka oli DMLS ja materiaali Ti-6Al-4V.
Kuva 9: Dmls: n valmistama proteesi (vasemmalla). Virtuaalisen geometrisen tarkastuksen tulos (oikealla).
viime aikoina useat tutkimukset ovat keskittyneet ominaisuuksien assosiaatioon implanttien valmistuksessa. Tämä tapahtuu esimerkiksi mekaanisten kestävyysominaisuuksien ja titaanikorroosion yhdistelmänä keramiikan kuten HA: n ja α-TCP: n bioaktiivisuuden kanssa.
Ning ja Zhou arvioivat ha-ja Ti-jauheista valmistetun biokomposiitin bioaktiivisuutta jauhemetallurgisella menetelmällä in vitro ja In vivo. Seokset eri suhteissa HA / Ti sekoitettiin ja syntetisoitiin 1200° C: n lämpötilassa.tulokset osoittavat, että komposiitit, joilla on korkein Ti-pitoisuus, pystyvät indusoimaan apatiitin nukleaatiota ja kasvua niiden pinnalla, mikä takaa luun kasvun ja tekee metalli – /keraamisista biokomposiiteista ehdokkaita luun korvaamiseksi.
Kim et al kerrostui tiheitä ja yhtenäisiä ha-ja FHA-kalvoja (hydroksiapatiitti-fluori), joiden paksuus oli ~ 5 µm titaanisubstraateissa sol-gel-tekniikkaa käyttäen. Substraatti aiheutti suotuisaa osteoblastien kasvua ja lisääntymistä, mikä lisäsi substraatin aktiivisuutta ja toimintaa.
samalla linjalla Bertol raportoi kaksi tapausta Ti: n ja α-TCP: n yhteydestä. Räätälöity implantti saatiin muokkaamalla potilaan fyysistä mallia käsin tomografisista kuvista (orbital floor), kun taas toinen koneistettiin tomografisista kuvista saadun virtuaalisen rakenteen mukaan (alaleuka). Molemmissa tapauksissa implantit pinnoitettiin α-TCP: llä ja toteutettiin onnistuneesti.
Kuva 10:
paitsi titaani, myös Kooseokset ovat käyttäneet keramiikkakomposiitteja parantaakseen joitakin sen ominaisuuksia. Yen et al raportti elektrolyyttinen pinnoite metalliseos Co-Cr-Mo ZrO2 hip proteesi. Tässä tapauksessa pinnoitteen käyttö vähensi metalliosan kulumista polymeerikomponenttia vastaan ja pienensi pintojen välistä kitkakerrointa.
Khan, S. F.; Dalgarno K. W. ”Customized Medical Implants by Layered Manufacturing”. School of Mechanical and Systems Engineering. NC University-UK.
Ma, D; Lin F; Chua C. K. ”Rapid Prototyping Applications in Medicine. Osa 1:NURBS-Based Volume Modelling”. International Journal of Advanced Manufacturing Technology. Springer-Verlag London Limited. 2001
Lima, B. C. ”Engenharia Reversa e Prototipagem Rápida: Estudo de Casos”. s. 15-16. 2003.
Shellabear, M; Nyrhilä, O. ”DMLS – Development History and State of the Art”. LANE, Erlanger. 2004.
Shellabear, M; Nyrhilä, O. ”Advances in Materials and Properties of Direct Metal Laser-Syntered Parts”. LANE, Erlanger. 2004.
Molleó, I. L. ”craniofacial anomalies, Genetics and Public Health: contributions to the recognition of the current situation of care in the Unified Health System”” Unicamp. 2004.
Lima Silva, J. J. de; Lima, A. A. S.; Torres ,S. M. ”face furtures: analysis of 105 cases”” Revista Brasileira de Cirurgia Craniomaxilofacial / Brazilian Association of Cranio-Maxillofacial Surgery. Vol.12, Nro 1 (Tammi.2009).
gopakumar, S. ” RP lääketieteessä: tapaustutkimus cranial reconstructive surgery ”” Rapid Prototyping Journal. Nide 10 * Number 3 * 2004 * s. 207-211.
Bertol, L. S. ”contribution to the study of rapid prototyping, three-dimensional digitization and selection of materials in the design of custom implants”” Master ’ s dissertation. Rio Grande do Sulin liittovaltion yliopisto. Porto Alegre. 2008.
Naber, H. ”Advances in rapid prototyping technologies”, Materials and Manufacturing Conference, Metalex, Thaimaa. 1998.
Gibson, I; Cheung, L. K; Chow, S. P; Cheung, W. L; well, S. L; Savalani, M; Lee, S. H. ”the use of rapid prototyping to assist medical applications”. Rapid Prototyping Journal 12/1 (2006) 53-58.
Hench, L. L. ”Bioceramics: from concept to Clinic”. J. Am. Keraamia. Soc., 74 (7) 1487-510 (1991).
Wu, W; Shang, Y; Li, H; Wang, W. ”Fabrication of repairing skull bone deficits based on the rapid prototyping”. Journal of Bioactive and Compatible Polymers, Vol. Toukokuuta 2009.
Bertol, L. s; Junior, W. K; Silva, F. P. d. ; Aumund-Kopp, C. ”Medical design: Direct metal laser sintering of Ti-6Al-4V”. Materiaalit ja suunnittelu (2010), doi: 10.1016/J.matdes.2010.02.050.
Oliveira, R. S. D; Brigato, R; Madureira, J. F. G; Cruz, A. A. V.; Filho, F. V. D. M; Alonso, N; Machado, H. R. ”Reconstruction of a large complex skull defect in a child: a case report and literature review”. Childs Nerv Syst (2007) 23:1097-1102.
Drstvensek, I; Hren, N. I; Strojnik, T; Brajlih, T; Valentan, B; Pogacar, V; Hartner, T. Z. ”Applications of Rapid Prototyping in Cranio-Maxilofacial Surgery Procedures”. Internacional Journal of Biology and biolääketieteen Engineering. Numero 1, osa 2, 2008.
Ning, C. Q; Zhou, Y. ”in vitro bioactivity of a biokomposiitti fabricated from HA and Ti powder by powder method. Biomaterials 23 (2002) 2909-2915.
Ning, C. Q; Zhou, Y. ”Correlations between the in vitro and in vivo bioactivity of the Ti / HA composites fabricated by a powder metallurgy method”. Acta Biomaterialia 4 (2008) 1944-1952.