Generic Name: epinastine hydrochloride
Dosage Form: ophthalmic solution
Medically reviewed by Drugs.com. Last updated on June 1, 2020.
- Overview
- Side Effects
- Dosage
- Professional
- Pregnancy
- More
Indications and Usage for Epinastine HCl Ophthalmic Solution
Epinastine HCl Ophthalmic Solution 0.05% on tarkoitettu allergisen sidekalvotulehduksen aiheuttaman kutinan ehkäisyyn.
Epinastiini HCl oftalminen liuos Annostus ja anto
suositeltu annos on yksi tippa kumpaankin silmään kahdesti päivässä.
hoitoa tulee jatkaa koko altistusajan (eli siitepölykauden päättymiseen asti tai kunnes altistuminen vahingolliselle allergeenille on päättynyt), vaikka oireita ei olisikaan.
annosmuodot ja vahvuudet
liuos, joka sisältää 0.5 mg/mL epinastiini HCl
vasta-aiheet
Ei mitään
Varoitukset ja varotoimet
kärjen ja liuoksen kontaminaatio
potilaita tulee neuvoa välttämään annostelusäiliön kärjen kosketusta silmiin, ympäröiviin rakenteisiin, sormiin tai mihin tahansa muuhun pintaan, jotta vältetään silmäinfektioita aiheuttavien tavallisten bakteerien kontaminaatio liuoksessa. Saastuneiden liuosten käyttö voi aiheuttaa vakavia silmävaurioita ja myöhemmin näön menetyksen.
pullo tulee pitää tiiviisti suljettuna, kun sitä ei käytetä.
käyttö piilolinssien kanssa
potilaita tulee neuvoa olemaan käyttämättä piilolinssiä, jos heidän silmänsä ovat punaiset. 0, 05% Epinastiini HCl oftalmista liuosta ei tule käyttää piilolinssiin liittyvän ärsytyksen hoitoon.
epinastine HCl Oftalmisessa liuoksessa 0, 05% bentsalkoniumkloridia oleva säilöntäaine voi imeytyä pehmeisiin piilolinsseihin. Piilolinssit on poistettava ennen 0, 05% Epinastine HCl oftalmisen liuoksen tiputtamista, ja ne voidaan asettaa uudelleen 10 minuutin kuluttua lääkkeen antamisesta.
vain paikallisesti silmään
Epinastiini HCl oftalminen liuos 0.05% on tarkoitettu vain paikalliseen silmään eikä injektiona tai suun kautta.
haittavaikutukset
kliiniset tutkimukset
koska kliinisiä tutkimuksia tehdään hyvin vaihtelevissa olosuhteissa, jonkin lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuslukuja ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa todettuihin haittavaikutuslukuihin, eivätkä ne välttämättä heijasta käytännössä havaittuja haittavaikutuksia.
useimmin ilmoitetut silmään kohdistuvat haittavaikutukset, joita esiintyi noin 1-10%: lla potilaista, olivat polttava tunne silmässä, follikuloosi, hyperemia ja kutina.
useimmin raportoidut muuhun kuin silmään kohdistuneet haittavaikutukset olivat infektio (kylmäoireet ja ylähengitystieinfektiot) noin 10%: lla potilaista ja päänsärky, nuha, sinuiitti, lisääntynyt yskä ja nielutulehdus noin 1-3%: lla potilaista.
jotkut näistä reaktioista olivat samankaltaisia kuin tutkittavana oleva perussairaus.
markkinoille tulon jälkeen
markkinoille tulon jälkeen on havaittu seuraavia reaktioita, kun Epinastiini HCl-oftalmista liuosta on käytetty 0, 05% kliinisessä käytössä. Koska ne ilmoitetaan vapaaehtoisesti populaatiosta, jonka koko on tuntematon, yleisyysarvioita ei voida tehdä. Reaktiot, jotka on valittu sisällytettäviksi joko niiden vakavuuden, raportointitiheyden, mahdollisen syy-yhteyden Epinastiini HCl oftalmiseen liuokseen 0, 05% tai näiden tekijöiden yhdistelmän vuoksi, ovat: lisääntynyt kyynelvuoto.
käyttö ERITYISPOPULAATIOISSA
raskaus
teratogeeniset vaikutukset
Raskauskategoria c
tiineillä rotilla tehdyssä alkio-ja sikiönkehitystutkimuksessa havaittiin emolle toksisia vaikutuksia, joilla ei ollut alkio-ja sikiövaikutuksia, kun oraalinen annos oli noin 150 000 kertaa ihmisen silmään suositeltu enimmäisannos (MROHD) mg/kg/vrk. Resorptioita ja keskenmenoja todettiin embryofetaalitutkimuksessa tiineillä kaneilla oraalisella annoksella, joka oli noin 55 000 kertaa suurempi kuin MROHD. Kummassakaan tutkimuksessa ei havaittu lääkkeiden aiheuttamia teratogeenisia vaikutuksia.
Epinastiini vähensi poikasten painon nousua, kun tiineille rotille annettiin suun kautta noin 90 000 kertaa suurempi annos kuin KÄÄNTEISHYLJINTÄ (MROHD).
ei kuitenkaan ole olemassa riittäviä ja hyvin kontrolloituja tutkimuksia käytöstä raskaana oleville naisille. Koska eläimillä tehdyt lisääntymistutkimukset eivät aina ennusta ihmisen vastetta, Epinastiini HCl oftalmista liuosta 0, 05% tulee käyttää raskauden aikana vain, jos mahdollinen hyöty oikeuttaa mahdollisen riskin sikiölle.
imettävät äidit
imettävillä rotilla tehdyssä tutkimuksessa havaittiin epinastiinin erittyvän äidinmaitoon. Ei tiedetä, erittyykö tämä lääke äidinmaitoon. Koska monet lääkkeet erittyvät äidinmaitoon, on noudatettava varovaisuutta annettaessa imettävälle naiselle 0, 05% Epinastiini HCl-oftalmista liuosta.
lapsipotilailla
turvallisuutta ja tehoa alle 2-vuotiailla lapsipotilailla ei ole osoitettu.
geriatrinen käyttö
iäkkäiden ja nuorempien potilaiden välillä ei ole havaittu yleisiä eroja turvallisuudessa tai tehossa.
Epinastiini HCl oftalminen liuos kuvaus
Epinastiini HCl oftalminen liuos 0.05% is a clear, colorless, sterile isotonic solution containing epinastine HCl, an antihistamine and an inhibitor of histamine release from the mast cell for topical administration to the eyes.
Epinastine HCl is represented by the following structural formula:
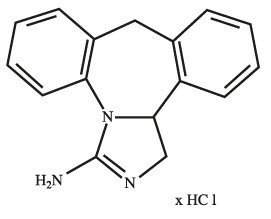
C16H15N3HCl Mol. Wt. 285.78
Chemical Name:
3-Amino-9,13b-dihydro-1H-dibenzimidazoazepine hydrochloride
Each mL contains: Active: Epinastine HCl 0.05% (0.5 mg/mL) equivalent to epinastine 0.044% (0.44 mg/mL); Preservative: Benzalkonium chloride 0.01%; Inactives: Dinatriumedetaatti, dihydraatti; puhdistettu vesi; natriumkloridi; natriumdivetyfosfaatti, vedetön; natriumhydroksidi ja / tai kloorivetyhappo (pH: n säätämiseksi).
Epinastiinihydrokloridiliuoksen pH 0, 05% on noin 7 ja osmolaliteetti 250-310 mOsm / kg.
Epinastiini HCl oftalminen liuos – Kliininen farmakologia
vaikutusmekanismi
Epinastiini on paikallisesti aktiivinen, suora H1-reseptorin antagonisti ja histamiinin vapautumisen estäjä syöttösolusta. Epinastiini on selektiivinen histamiini H1-reseptorille ja sillä on affiniteetti histamiini H2-reseptoriin. Epinastiinilla on affiniteettia myös α1 -, α2-ja 5–HT2-reseptoreihin.
farmakokinetiikka
neljätoista allergista sidekalvontulehdusta sairastavaa henkilöä sai yhden pisaran Epinastiini HCl-oftalmista liuosta 0, 05% kumpaankin silmään kahdesti päivässä 7 vuorokauden ajan. Päivänä 7 epinastiinin keskimääräinen huippupitoisuus plasmassa oli 0, 04±0, 014 ng/ml noin kahden tunnin kuluttua, mikä viittaa alhaiseen systeemiseen altistukseen. Vaikka nämä pitoisuudet merkitsivät nousua kerta-annoksen jälkeen havaittuihin pitoisuuksiin verrattuna, vuorokausien 1 ja 7 AUC-arvot pysyivät muuttumattomina, mikä viittaa siihen, ettei systeeminen imeytyminen lisäänny toistuvien annosten yhteydessä. Epinastiini sitoutuu 64-prosenttisesti plasman proteiineihin. Systeeminen kokonaispuhdistuma on noin 56 L/h ja terminaalinen eliminaation puoliintumisaika plasmassa on noin 12 tuntia. Epinastiini erittyy pääasiassa muuttumattomana. Noin 55% laskimonsisäisestä annoksesta erittyy muuttumattomana virtsaan ja noin 30% ulosteeseen. Alle 10% metaboloituu. Eliminaatio tapahtuu pääasiassa aktiivisen tubulussekreetion kautta.
ei-kliininen toksisuus
karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
18 kuukauden tai 2 vuoden ruokavalion karsinogeenisuustutkimuksissa hiirillä tai rotilla epinastiini ei ollut karsinogeeninen enintään 40 mg / kg annoksilla .
Epinastiinin mutageenisuus oli negatiivinen uusissa syntetisoiduissa erissä Ames / Salmonella-määrityksessä ja in vitro-kromosomipoikkeavuustutkimuksessa, jossa käytettiin ihmisen lymfosyyttejä. Positiivisia tuloksia saatiin varhaisista epinastiinieristä kahdessa in vitro-kromosomipoikkeavuustutkimuksessa, jotka tehtiin 1980-luvulla ihmisen perifeerisillä lymfosyyteillä ja V79-soluilla. Epinastiini oli negatiivinen in vivo klastogeenisuustutkimuksissa, mukaan lukien hiiren mikrotumatesti ja kromosomipoikkeavuustesti kiinalaisilla hamstereilla. Epinastiini oli negatiivinen myös solujen transformaatiokokeessa, jossa käytettiin Syyrianhamsterin alkiosoluja, V79/HGPRT nisäkässolupistemutaatiokokeessa ja in vivo/in vitro unscheduled DNA synthesis-määrityksessä, jossa käytettiin rotan primaarisia maksasoluja.
Epinastiini ei vaikuttanut urosrottien hedelmällisyyteen. Naarasrotilla havaittiin hedelmällisyyden heikkenemistä suun kautta annetuilla annoksilla, jotka olivat noin 90 000-kertaisia KÄÄNTEISHYLJINTÄÄN verrattuna.
kliiniset tutkimukset
Epinastiini HCl 0, 05%: n on osoitettu olevan merkitsevästi vehikkeliä parempi silmän kutinan parantamisessa potilailla, joilla on allerginen sidekalvotulehdus kliinisissä tutkimuksissa, joissa käytettiin kahta eri mallia: (1) sidekalvon antigeenihaaste (CAC), jossa potilaille annettiin ja sitten annettiin antigeenia alempaan sidekalvon fornixiin; ja (2) ympäristökenttätutkimukset, joissa potilaille annettiin ja arvioitiin allergiakauden aikana heidän luonnollisessa elinympäristössään. Tulokset osoittivat, että epinastiini HCl 0, 05%: n vaikutus alkaa nopeasti 3-5 minuutin kuluessa sidekalvon antigeenialtistuksen jälkeen. Vaikutuksen keston osoitettiin olevan 8 tuntia, joten annostelu kahdesti päivässä oli sopiva. Tämä annosteluohjelma osoittautui turvalliseksi ja tehokkaaksi 8 viikon ajan ilman merkkejä takyfylaksiasta.
miten toimitetaan/säilytys ja käsittely
Epinastiini HCl oftalminen liuos 0.05% on saatavana steriilinä läpinäkymättömässä valkoisessa LDPE – muovipullossa, jossa on tiputuskärjet ja valkoinen polypropeeni (PP) korkki seuraavasti:
| 5 mL 10 mL: n pullossa | NDC 51991-836-75 |
varastointi: Säilytä 20° – 25°C (68° – 77°F) . Pidä pullo tiiviisti suljettuna ja poissa lasten ulottuvilta.
potilaan neuvontaa koskevat tiedot
Tiputuskärjen steriiliys
potilaita tulee neuvoa olemaan koskematta tiputuskärkeä mihinkään pintaan, koska se voi saastuttaa sisällön (KS.varoitukset ja varotoimet, 5. 1).
piilolinssien samanaikainen käyttö
potilaita tulee neuvoa olemaan käyttämättä piilolinssiä, jos heidän silmänsä ovat punaiset. Potilaille tulee kertoa, että 0, 05% Epinastiini HCl oftalmista liuosta ei tule käyttää piilolinssiin liittyvän ärsytyksen hoitoon. Potilaita tulee myös neuvoa poistamaan piilolinssit ennen 0, 05% Epinastine HCl oftalmisen liuoksen tiputtamista.
epinastine HCl Oftalmisessa liuoksessa 0, 05% bentsalkoniumkloridia oleva säilöntäaine voi imeytyä pehmeisiin piilolinsseihin. Linssit voidaan asentaa uudelleen 10 minuutin kuluttua Epinastine HCl oftalmista liuosta 0, 05%
vain oftalmista Paikallisesti
vain oftalmista paikallisesti annettuna.
RX only
Distributed by:
Breckenridge Pharmaceutical, Inc.
Berlin, CT 06037
valmistaja:
PrimaPharma, Inc.
San Diego, CA 92121
Rev: 04/2020
2323 04/20
PRINCIPAL DISPLAY PANEL – 5 mL Bottle Carton
NDC 51991-836-75
Epinastine HCl
Ophthalmic
Solution,
0.05%
FOR USE IN THE
EYES ONLY
sterile
Rx Only
5 mL sterile
breckenridge
A Towa
Company

| EPINASTINE HYDROCHLORIDE epinastine hydrochloride solution/ drops |
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
Labeler – Breckenridge Pharmaceutical, Inc. (150554335)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| PrimaPharma, Inc. | 079699106 | MANUFACTURE(51991-836) | |
lisää epinastiinioireyhtymästä
- haittavaikutukset
- annostustiedot
- englanniksi
- 3 arviota
- Lääkeluokka: oftalmologiset antihistamiinit ja dekongestantit
raskauden tai imetyksen aikana
innoittelu & kuponkeja
Consumer resources
- potilastiedot
- Epinastiini oftalminen (Advanced Reading)
Ammattiresurssit
muut merkit Elestat
asiaan liittyvät hoito-oppaat
- sidekalvotulehdus, allerginen
lääketieteellinen Vastuuvapauslauseke