dipólusok
a nem kovalens kölcsönhatások természetének megértéséhez először vissza kell térnünk a kovalens kötésekhez, és el kell mélyednünk a dipólusok témájában. Az általunk látott kovalens kötések közül sok – például két szén, vagy egy szén és egy hidrogén között –magában foglalja az elektronok megközelítőleg egyenlő megosztását a kötés két atomja között. Ezekben a példákban a két atom körülbelül azonos elektronegativitással rendelkezik. Emlékezzünk vissza az általános kémiai tanfolyamról, hogy az elektronegativitás “egy molekula atomjának erejére utal, hogy magához vonzza az elektronokat” (ezt a meghatározást Linus Pauling, a kiemelkedő 20.századi amerikai vegyész ajánlotta fel, aki elsősorban a sok kötési koncepció kidolgozásáért volt felelős, amelyeket tanultunk).
a szerves kémiában azonban gyakran két különböző elektronegativitású Atom kovalens kötésével foglalkozunk, és ezekben az esetekben az elektronok megosztása nem egyenlő: minél elektronegatívabb a mag, annál közelebb húzza a két elektronot. Például egy alkohol szén-oxigén kötésében a szigma kötésben lévő két elektron szorosabban kötődik az oxigénhez, mint a szénhez, mert az oxigén lényegesen elektronegatívabb, mint a szén. Ugyanez igaz az oxigén-hidrogén kötésre is, mivel a hidrogén valamivel kevésbé elektronegatív, mint a szén, és sokkal kevésbé elektronegatív, mint az oxigén.
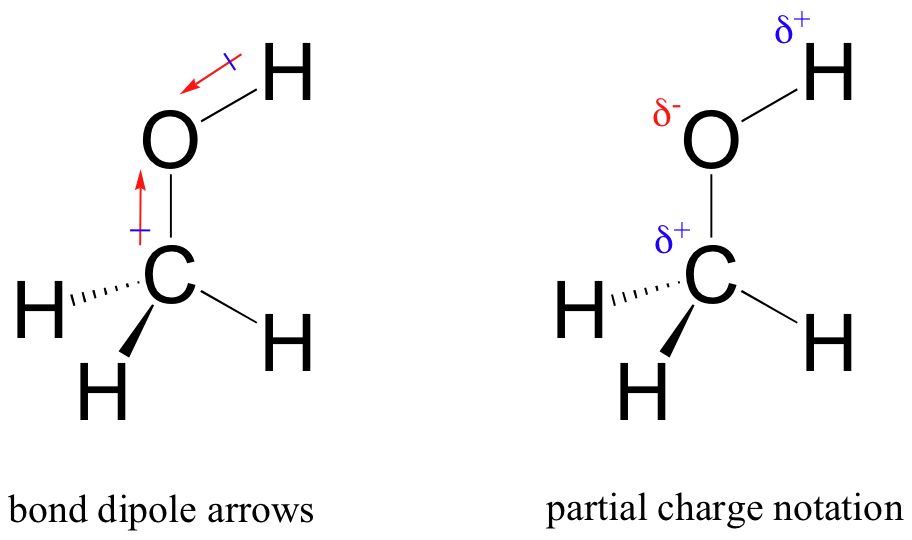
ennek az egyenlőtlen megosztásnak az eredménye az, amit kötési dipólusnak nevezünk, amely egy poláris kovalens kötésben létezik. A kötés dipólusának mind negatív, mind pozitív vége van, vagy pólusok, ahol az elektron sűrűsége alacsonyabb (a pozitív pólus) és magasabb (a negatív pólus). Az elektronsűrűség különbségét a görög delta betűvel lehet kifejezni az atomok’ részleges pozitív ‘és’ részleges negatív ‘ töltésének jelölésére. A’ dipólus nyilakat’, amelyek pozitív előjellel rendelkeznek a farokon, szintén használják a dipólus negatív (nagyobb elektronsűrűségű) irányának jelzésére.
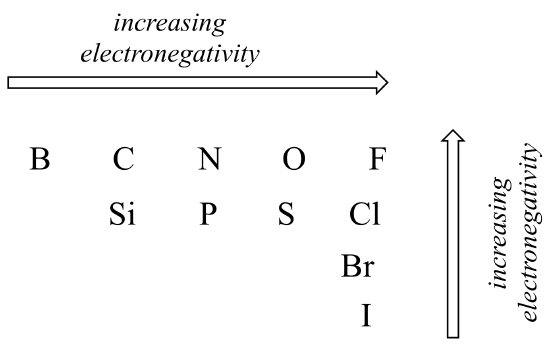
a kovalens kötés polaritásának mértéke a két atom közötti Elektronegativitás különbségétől függ. Az elektronegativitás periodikus trend: balról jobbra haladva növekszik az elemek periódusos táblázatának egy sorában, és növekszik, amikor felfelé haladunk egy oszlopon. Ezért az oxigén elektronegatívabb, mint a nitrogén, ami viszont elektronegatívabb, mint a szén. Az oxigén szintén elektronegatívabb, mint a kén. A fluor, a periódusos rendszer jobb felső sarkában, az elemek közül a leginkább elektronegatív. A hidrogén valamivel kevésbé elektronegatív, mint a szén.
periodikus tendenciák az elektronegativitásban
2.26 gyakorlat
az atompályákkal kapcsolatos információk felhasználásával ésszerűsítse az elektronegativitás periodikus trendjeit. Miért növekszik balról jobbra, és csökken fentről lefelé? Ez egy jó kérdés, hogy beszéljen az osztálytársakkal és egy oktatóval vagy oktatóval.
gyakorlatok megoldásai
a legtöbb molekula poláris és nem poláris kovalens kötéseket is tartalmaz. A poláris kötések helyétől és a kötési geometriától függően a molekulák rendelkezhetnek nettó polaritással, amelyet molekuláris dipólusmomentumnak neveznek. A víznek, amint valószínűleg emlékszel, van egy dipólus pillanata, amely két oxigén-hidrogén kötésének kombinált dipólusaiból származik. A fluorometánnak is van egy dipólus momentuma.
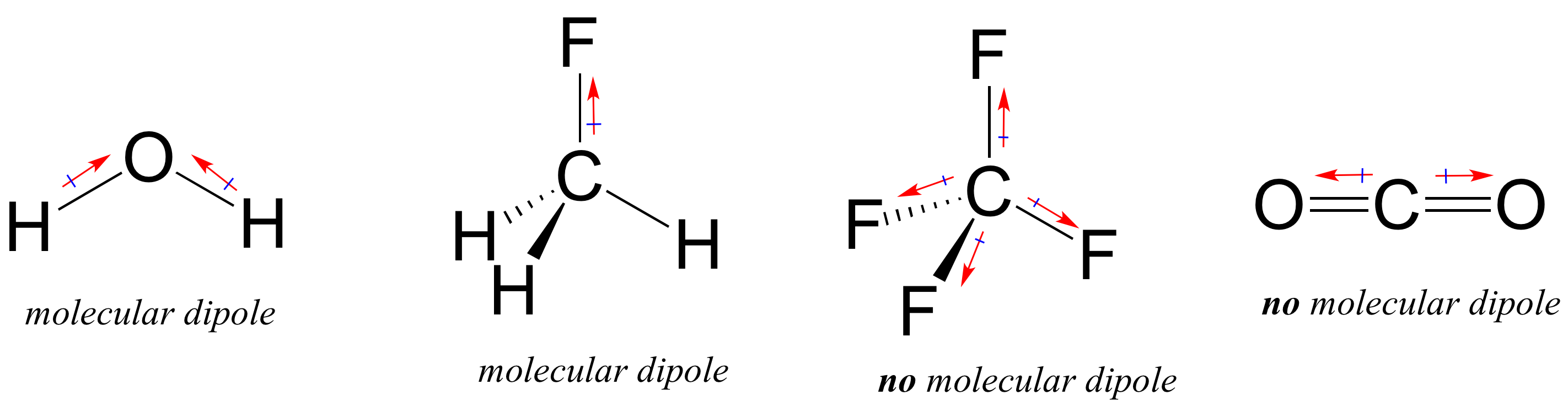
a tetrafluor-metánnak azonban négy poláris kötése van, amelyek egyformán behúzódnak a tetaéder négy sarkába, ami azt jelenti, hogy bár négy kötési dipólus van, nincs teljes molekuláris dipólus pillanat. A szén-dioxidnak szintén nincs molekuláris dipólus pillanata.
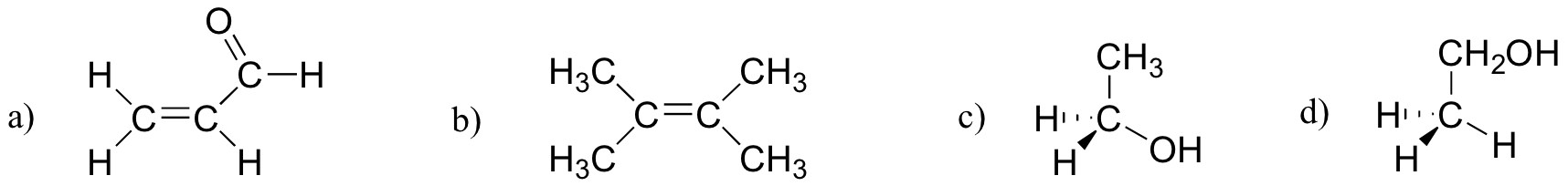
2.27 gyakorlat
az alábbi molekulák közül melyiknek van molekuláris dipólus momentuma?
gyakorlatok megoldásai