tények, Összefoglalás & definíció
- az adduct egy addíciós reakció által alkotott termék
- az Adduktok csak olyan reagensekből állíthatók elő, amelyek több kötéssel rendelkeznek, mint például alkének és karbonilcsoportok
- az Adduktok kétféle addíciós reakcióval hozhatók létre reakció: elektrofil és nukleofil
- adduktumok gyakran alakulnak ki Lewis-savak és Lewis-bázisok között
mi az adduktum?
az adduktum egy addíciós reakció végén képződő termék. Ez egy olyan reakció, amelyben két vagy több molekula reagál és egyesül, hogy egy nagyobb terméket képezzen. Ez a fajta reakció csak olyan kémiai vegyületek között fordulhat elő, amelyek több kötéssel rendelkeznek – olyan vegyületek, mint az alkének (kettős kötések) és az alkinek (hármas kötések). A karbonil (C=O) és imin (C=N) csoportok addíciós reakciókon is áteshetnek, és így adduktokat képezhetnek.
hogyan alakulnak ki az adduktok?
mint korábban említettük, adduktumok addíciós reakciók révén alakulnak ki. Az ilyen típusú reakcióban a kettős kötés részben megszakad, amikor egy reagáló molekula megtámad és továbbad. Az alábbi reakció az etén és a bróm közötti addíciós reakciót mutatja.

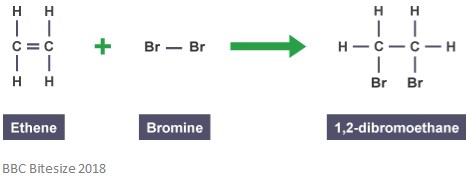
az adduktum ebben a reakcióban 1,2-dibrómetán. Ez azért van, mert ez egy különálló faj, amely az összes komponens összes atomját tartalmazza.
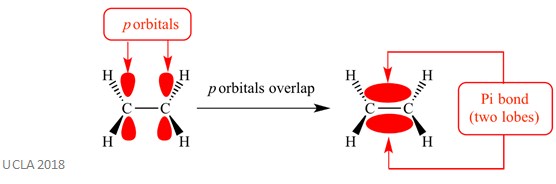
Ezek az addíciós reakciók általában pi ( ++ ) kötéseket tartalmaznak. Ez egy összetett típusú kötés, amelyben a szomszédos atomok p pályái átfedik egymást-ez az átfedés okozza a pi kötést. Ez merőleges a két azonos atom közötti szigma kötésekre. Ennek a pi kötésnek két orbitális lebenye is van – az egyik a sigma kötés síkja felett van, a másik pedig a sigma kötés síkja alatt van. A pi kötést az alábbi ábra mutatja.

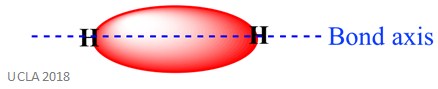
ugyanez a reakció magában foglalhatja a szigma () kötéseket is. Ez egyfajta kovalens kötésforma az atompályák átfedésével a kötési tengely mentén-más szóval a két kötött atomot összekötő vonal mentén. Például a hidrogénatomban lévő szigma kötést két 1S pálya átfedése képezi-mindegyik hidrogénatomból egyet. Ez jobban látható az alábbi képen-a piros terület a sigma kötést mutatja.

az addíciós reakciónak két fő típusa van: elektrofil addíció és nukleofil addíció.
elektrofil addíció
az elektrofil addíciós reakció olyan típusú reakció, amelyben egy kötés megszakad, és két új kötés keletkezik. Amint azt korábban tárgyaltuk, a reagensnek kettős vagy hármas kötéssel kell rendelkeznie – ebben az esetben az elektrofil hozzáadja a pi kötést. Ez egy addíciós reakció, tehát semmi sem vész el a folyamat során – a reagens molekulákban található összes atom megtalálható az adduktumban is.

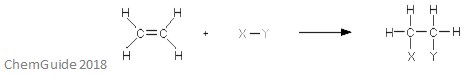
a fenti kép egy elektrofil addíciós reakció alapját mutatja. Mint láthatja, a reagensek összes atomja megtalálható az adduktumban.
nukleofil addíció
a nukleofil addíciós reakció olyan típusú reakció, amelyben kettős kötés megszakad, és két egyszeri kötés képződik. Egy elektron-hiányos (elektrofil) kettős vagy hármas kötés reagál valamivel, ami elektronban gazdag (nukleofil). Ebben az esetben a nukleofil hozzáadja a pi kötést. Az alábbiakban egy nukleofil addíciós reakció példáját mutatjuk be.

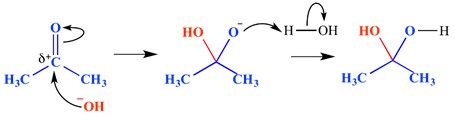
ebben a példában egy hidroxidion került a karbonilcsoport delta pozitív végéhez – ez oxianionos tetraéderes közbenső molekulát alkotott. A végeredmény tehát a víz hozzáadása a karbonilcsoport pi kötésén keresztül.
Lewis-savak és Lewis-bázisok
Adduktumok gyakran ismertek Lewis-savak és Lewis-bázisok között. A képződött molekulát Lewis-sav-bázis adduktnak (vagy Lewis-sav-bázis komplexnek) nevezzük. Mivel az adduktumok csak addíciós reakciók révén alakulnak ki (vagyis egy csoport egyidejű elvesztése nélkül), a Lewis-sav és a Lewis-bázis reakciók nem lehetnek szubsztitúciós reakciók.
jó példa erre a THF és a BH3 közötti reakció, amely az alábbi képen látható. Mint látni fogja, ezek a Lewis-sav – Lewis bázis adduktumok pontokkal vannak ábrázolva-ezek elektronokat képviselnek.

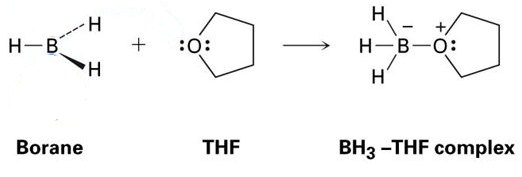
mint látható, az egyetlen létrehozott termék a BH3-THF komplex, ami azt jelenti, hogy egy adduktum.
az ilyen típusú reakciók nyilakkal is ábrázolhatók-ezek a nyilak az elektronok adományozását jelentik a bázistól a savig. Ugyanez a reakció látható az alábbiakban, de nyilakkal jelzi az elektron adományozását.

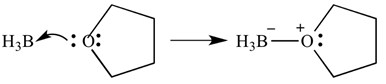
itt fontos megjegyezni, hogy ezeknek a nyilaknak két “szöge” van a hegyes végén. Ez azt jelzi, hogy egy elektronpárt adományoztak. Ha csak egy elektront adományoznak, a nyílnak csak egy bárdja lesz a hegyes végén.
ebben az esetben a Lewis-sav borán, a Lewis-bázis pedig THF. Mint láthatja, a bázis egy magányos elektronpárt adományozott a savnak, hogy oxigén-bór kötést képezzen.
azokat a vegyületeket, amelyek a molekulák alakja miatt nem képesek adduktokat képezni, frusztrált Lewis-pároknak nevezzük.
további olvasmányok
http://www.chem.ucla.edu/~harding/IGOC/L/lewis_acid_base_adduct.html