VIVO patofiziológia
Egyéb témák
aquaporinok: vízcsatornák
a víz két úton keresztezi a sejtmembránokat: diffúzióval a lipid kettős rétegen keresztül és az aquaporinoknak nevezett vízcsatornákon keresztül. Az első aquaporin funkcionális jellemzéséről 1992-ben számoltak be, de a vízcsatornák feltételezhetően jóval azelőtt léteztek, mert bizonyos típusú hámsejtek ozmotikus permeabilitása túl nagy volt ahhoz, hogy a plazmamembránon keresztüli egyszerű diffúzióval lehessen elszámolni.
egyetlen emberi akvaporin-1 csatorna körülbelül 3 milliárd vízmolekula / másodperc sebességgel megkönnyíti a vízi szállítást. Az ilyen szállítás kétirányúnak tűnik, az uralkodó ozmotikus gradiensnek megfelelően.
a klasszikus akvaporinok oldott anyagmentes vizet szállítanak a sejtmembránokon; úgy tűnik, hogy kizárólagos vízcsatornák, és nem hatolják át a membránokat ionokba vagy más kis molekulákba. Néhány aquaporin-az úgynevezett aquagliceroporinok-vizet, valamint glicerint és néhány más kis molekulát szállítanak.
az Aquaporin család
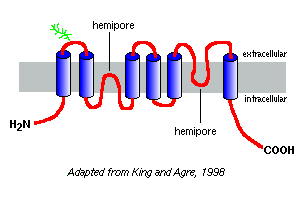
a mai napig több mint 10 különböző emlős aquaporint azonosítottak, és további tagok fennállásának gyanúja áll fenn. A közeli rokonságban álló vízcsatorna fehérjéket izolálták növényekből, rovarokból és baktériumokból. Az emberi vörösvérsejtekből származó Aquaporin-1 volt az első, amelyet felfedeztek, és valószínűleg a legjobban tanulmányozták.
aminosav-szekvenciáik Hidrofobicitási diagramjai azt jósolják, hogy az aquaporinoknak hat membránon átívelő szegmense van, amint azt a aquaporin-1 jobb oldalon.
az aquaporin-1-vel végzett vizsgálatok alapján úgy tűnik, hogy az aquaporinok a plazmamembránban léteznek homotetramerek. Minden aquaporin monomer két hemi-pórust tartalmaz, amelyek összehajtva vízcsatornát képeznek.
a különböző akvaporinok különböző glikozilezési mintázattal rendelkeznek. Az aquaporin-1 esetében a peptid gerince nagyjából 28 kDa, a glikozilált formák tömege 40-60 kDa. A legtöbb akvaporinnak van egy protein kináz a foszforilációs motívuma az egyik citoplazmatikus hurokban, és a differenciális foszforiláció gyanúja szerint a molekula szabályozó funkciója.
az Aquaporin expressziójának mintái
mindegyik aquaporin lényegében egyedi expressziós mintázattal rendelkezik a szövetek között és a fejlődés során. Ezen tulajdonságok és néhány fontos potenciál vagy ismert funkció összefoglalását a következő táblázat tartalmazza:
| Aquaporin-0 | szem: lencse szálas sejtek | folyadék egyensúly a lencsén belül |
|---|---|---|
| aquaporin-1 | vörösvérsejtek | ozmotikus védelem |
| vese: proximal tubule | Concentration of urine | Eye: ciliary epithelium | Production of aqueous humor | Brain: choriod plexus | Production of cerebrospinal fluid | Lung: alveolar epithelial cells | Alveolar hydration state |
| Aquaporin-2 | Kidney: collecting ducts | Mediates antidiuretic hormone activity |
| Aquaporin-3 * | Kidney: collecting ducts | Reabsorbtion of water into blood |
| Trachea: epitheliális sejtek | a víz kiválasztása a légcsőbe | |
| Aquaporin-4 | vese: gyűjtőcsatornák | a víz újbóli felszívódása |
| agy: ependimális sejtek | CSF folyadékegyensúly | |
| agy: hipotalamusz | Osmosensing funkció? | hörgő folyadék szekréció |
| Aquaporin-5 | nyálmirigyek | nyál termelése | könnymirigyek | könnytermelés |
| Aquaporin-6 | vese | nagyon alacsony vízáteresztő képesség; funkció? |
| Aquaporin-7 * | zsírsejtek | szállítja glicerin ki adipociták |
| Here és a sperma | ||
| Aquaporin-8 | here, hasnyálmirigy, máj, egyéb | |
| aquaporin-9 * | leukociták | |
| * egy aquagliceroporin | ||
világosnak kell lennie aquaporins nagyon széles körben elterjedt, valamint, hogy a különböző aquaporins különböző funkcionálisan fontos specialitások.
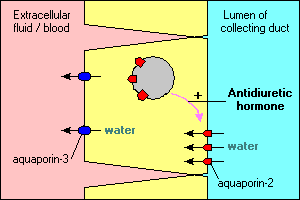
az aquaporin által közvetített vízszállítás számos érdekes és fontos jellemzőjét szemléltetik azok a fő sejtek, amelyek a vesében gyűjtőcsatornákat vezetnek. Az ezeken a csatornákon átfolyó víz tovább folytatódhat és kiürülhet a vizeletben, vagy újra felszívódhat az epitheliumon keresztül és vissza a vérbe. A reabszorpció lényegében nulla, kivéve, ha a hámsejtek antidiuretikus hormont látnak, amely erősen stimulálja a víz reabszorpcióját. A csatornacellák összegyűjtése legalább két aquaporint expresszál:
- az Aquaporin-2 szintetizálódik, de antidiuretikus hormon hiányában a citoplazmában lévő membránhólyagok medencéjében található. Az antidiuretikus hormon kötődése a sejt receptorához nemcsak az aquaporin-2 gén transzkripcióját stimulálja, hanem az aquaporin-2 intracelluláris medencéjét is behelyezi az apikális membránba. A sejt most képes hatékonyan felvenni a vizet a csatorna lumenéből.
- az Aquaporin-3 konstitutívan expresszálódik a sejt bazolaterális membránjában. Amikor a víz az aquaporin-2 csatornákon keresztül áramlik a sejtbe, gyorsan kiléphet a sejtből az aquaporin-3 csatornákon keresztül, és véráramba áramlik.
Aquaporins and Disease
figyelembe véve a vízi közlekedés fontosságát számtalan fiziológiai folyamatban, várható, hogy az aquaporin gének elváltozásai vagy az aquaporinok szerzett diszfunkciója számos betegségállapotot okozhat vagy hozzájárulhat ahhoz. Az ilyen kapcsolatok keresése még korai, de a betegség két egyértelmű példáját azonosították az aquaporinok hiányából eredően:
- az aquaporin-2 gén mutációi örökletes nephrogén diabetes insipidust okoznak az emberekben.
- az aquaporin-0 gén mutációinak inaktiválására homozigóta Egerek veleszületett szürkehályogot fejlesztenek ki.
- felnőttkori elhízás alakul ki egerekben homozigóta mutációk inaktiválására az aquaporin – 7 génben, feltehetően a glicerin hidrolizált trigliceridraktárakból történő szállításának hatékonysága miatt.
kevés embert azonosítottak az aquaporin-1 súlyos vagy teljes hiányával. Érdekes módon klinikailag nem befolyásoltak, de a vízhiány körülményei között nem vizsgálták őket. Az aquaporin-1-ben célzott delécióval rendelkező egerek szintén normálisnak és egészségesnek tűnnek, kivéve, ha folyadékkorlátozottak, ebben az esetben súlyosan hiperozmolárisak lesznek.
referenciák és vélemények
- Borgnia M, Nielsen S, Engel A, Agre P: az aquaporin vízcsatornák sejt-és molekuláris biológiája. Annu Rev Biochem 68: 425, 1999.
- DeGroot BL, Grubmuller H: vízáteresztés a biológiai membránokon: az aquaporin-1 és a GlpF mechanizmusa és dinamikája. Tudomány 294:2353, 2001.
- Hibuse T, Proc Nat Acad Sci (USA) 102:10993, 2005.
- király LS, Agre P: az aquaporin vízcsatornák patofiziológiája. Annu Rev Physiol 58:619, 1998.
- Kepper MA, Inoue t: az aquaporin-2 vízcsatorna-kereskedelem szabályozása vazopresszinnel. Curr Vélemény Cell Biol 9: 560, 1997.
- Lee MD, King LS, Agre P: az aquaporin vízcsatorna-fehérjék családja a klinikai orvoslásban. Orvostudomány 76: 141, 1997.
- Preston GM, Carroll TP, Guggino WP Agre P: vízcsatornák megjelenése a vörösvérsejt CHIP28 fehérjét expresszáló Xenopus petesejtekben. Tudomány 256: 385, 1992.
- Sasaki S, Ishibashi K, Marumo F: Aquaporin-2 és -3: az aquaporin család két alcsoportjának képviselői kolokalizáltak a vesegyűjtő csatornában. Annu Rev Physiol 60:199, 1998.