Generic Name: epinastine hydrochloride
Dosage Form: ophthalmic solution
Medically reviewed by Drugs.com. Last updated on June 1, 2020.
- Overview
- Side Effects
- Dosage
- Professional
- Pregnancy
- More
Indications and Usage for Epinastine HCl Ophthalmic Solution
Epinastine HCl Ophthalmic Solution 0.05% az allergiás kötőhártya-gyulladással járó viszketés megelőzésére javallt.
Epinastine HCl szemészeti oldat Adagolás és alkalmazás
az ajánlott adag naponta kétszer egy csepp mindkét szembe.
a kezelést az expozíció teljes időtartama alatt folytatni kell (azaz a pollenszezon végéig vagy a jogsértő allergénnek való kitettség megszűnéséig), még akkor is, ha a tünetek hiányoznak.
adagolási formák és hatáserősségek
0-t tartalmazó oldat.5 mg/mL Epinasztin HCl
ellenjavallatok
nincs
figyelmeztetések és óvintézkedések
A hegy és az oldat szennyeződése
a betegeket figyelmeztetni kell arra, hogy ne engedjék, hogy az adagolóedény csúcsa érintkezzen a szemmel, a környező struktúrákkal, az ujjakkal vagy bármely más felülettel annak érdekében, hogy elkerüljék az oldat olyan gyakori baktériumokkal való szennyeződését, amelyekről ismert, hogy szemfertőzést okoznak. A szennyezett oldatok használata súlyos szemkárosodást és ezt követő látásvesztést okozhat.
a palackot szorosan lezárva kell tartani, ha nem használja.
kontaktlencsével történő alkalmazás
a betegeknek azt kell tanácsolni, hogy ne viseljenek kontaktlencsét, ha a szemük vörös. Az epinastine HCl szemészeti oldat 0, 05% Nem alkalmazható kontaktlencsével kapcsolatos irritáció kezelésére.
a 0,05% – os Epinasztin HCl szemészeti oldatban lévő tartósítószer, a benzalkónium-klorid, lágy kontaktlencsékkel felszívódhat. A kontaktlencséket az epinastine HCl szemészeti oldat 0,05% – os becseppentése előtt el kell távolítani, majd a beadást követő 10 perc elteltével vissza lehet helyezni.
csak helyi szemészeti alkalmazás
Epinasztin HCl szemészeti oldat 0.05% csak helyi szemészeti alkalmazásra, nem pedig injekcióra vagy szájon át történő alkalmazásra.
mellékhatások
klinikai vizsgálatok tapasztalatai
mivel a klinikai vizsgálatokat nagyon eltérő körülmények között végzik, a gyógyszer klinikai vizsgálataiban megfigyelt mellékhatások aránya nem hasonlítható össze közvetlenül egy másik gyógyszer klinikai vizsgálataiban megfigyelt gyakorisággal, és nem feltétlenül tükrözi a gyakorlatban megfigyelt arányokat.
a betegek körülbelül 1-10% – ánál leggyakrabban jelentett szemészeti mellékhatások a szem égő érzése, folliculosis, hyperemia és pruritus voltak.
a leggyakrabban jelentett nem szemészeti mellékhatások a betegek körülbelül 10% – ánál észlelt fertőzés (megfázásos tünetek és felső légúti fertőzések), valamint a fejfájás, rhinitis, sinusitis, fokozott köhögés és pharyngitis voltak, melyeket a betegek körülbelül 1-3% – ánál észleltek.
Ezen reakciók némelyike hasonló volt a vizsgált alapbetegséghez.
forgalomba hozatalt követő tapasztalatok
a klinikai gyakorlatban az Epinastine HCl szemészeti oldat 0,05% – os alkalmazása során a következő reakciókat azonosították. Mivel ismeretlen méretű populációból önként jelentik őket, a gyakoriságot nem lehet megbecsülni. Azok a reakciók, amelyeket súlyosságuk, a jelentések gyakorisága, az epinasztin HCl szemészeti oldattal való lehetséges ok-okozati összefüggés 0, 05%, vagy ezen tényezők kombinációja miatt választottak be, a következők: fokozott könnyezés.
alkalmazás specifikus populációkban
terhesség
teratogén hatások
terhesség C Kategória
vemhes patkányokon végzett embriofetális fejlődési vizsgálatban embriofetális hatás nélküli anyai toxicitást figyeltek meg olyan orális adag mellett, amely körülbelül 150 000-szerese volt az ajánlott maximális szemészeti humán dózisnak (MROHD), amely mg/kg alapon 0,0014 mg/ttkg/nap volt. Vemhes nyulakon végzett embriofetális vizsgálatban teljes felszívódást és abortuszt figyeltek meg az MROHD körülbelül 55 000-szeresének megfelelő orális adaggal. Mindkét vizsgálatban nem észleltek gyógyszer által kiváltott teratogén hatásokat.
az Epinasztin csökkentette a kölykök testtömegnövekedését vemhes patkányoknak adott orális adag után, amely az MROHD körülbelül 90 000-szerese volt.
azonban terhes nőkön nem végeztek megfelelő és jól kontrollált vizsgálatokat. Mivel az állatokon végzett reprodukciós vizsgálatok nem mindig jelzik előre a humán választ, az Epinastine HCl 0,05% – os szemészeti oldat terhesség alatt csak akkor alkalmazható, ha a lehetséges előny meghaladja a magzatra gyakorolt potenciális kockázatot.
szoptató anyák
egy szoptató patkányokon végzett vizsgálat kimutatta, hogy az epinasztin kiválasztódik az anyatejbe. Nem ismert, hogy ez a gyógyszer kiválasztódik-e az anyatejbe. Mivel sok gyógyszer kiválasztódik az anyatejbe, óvatosan kell eljárni, ha az epinastine HCl 0,05% – os szemészeti oldatot adnak szoptató nőnek.
gyermekgyógyászati alkalmazás
a biztonságosságot és a hatékonyságot 2 évesnél fiatalabb gyermekgyógyászati betegeknél nem igazolták.
geriátriai alkalmazás
általános biztonságossági vagy hatásossági különbségeket nem figyeltek meg idős és fiatalabb betegek között.
Epinasztin HCl szemészeti oldat leírás
Epinasztin HCl szemészeti oldat 0.05% is a clear, colorless, sterile isotonic solution containing epinastine HCl, an antihistamine and an inhibitor of histamine release from the mast cell for topical administration to the eyes.
Epinastine HCl is represented by the following structural formula:
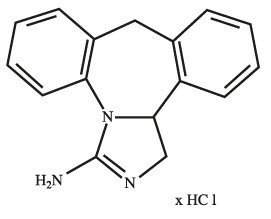
C16H15N3HCl Mol. Wt. 285.78
Chemical Name:
3-Amino-9,13b-dihydro-1H-dibenzimidazoazepine hydrochloride
Each mL contains: Active: Epinastine HCl 0.05% (0.5 mg/mL) equivalent to epinastine 0.044% (0.44 mg/mL); Preservative: Benzalkonium chloride 0.01%; Inactives: Dinátrium-edetát, dihidrát; tisztított víz; nátrium-klorid; egybázisú, vízmentes nátrium-foszfát; és nátrium-hidroxid és/vagy sósav (a pH beállításához).
a 0,05% – os Epinasztin HCl szemészeti oldat pH-ja körülbelül 7, ozmolalitása pedig 250-310 mOsm/kg.
Epinasztin HCl szemészeti oldat-Klinikai farmakológia
hatásmechanizmus
az Epinasztin helyileg aktív, közvetlen H1-receptor antagonista és gátolja a hisztamin felszabadulását a hízósejtből. Az epinasztin szelektív a hisztamin H1-receptorra, és affinitása van a hisztamin H2-receptorra. Az epinasztin affinitással rendelkezik a CAC-1, A CC-2 és az 5HT-2 receptorok iránt is.
farmakokinetika
tizennégy, allergiás kötőhártya-gyulladásban szenvedő beteg kapott egy csepp Epinastine HCl szemészeti oldatot, 0,05% – ot mindkét szemben, naponta kétszer, 7 napig. A 7.napon az epinasztin átlagos maximális plazmakoncentrációja körülbelül két óra elteltével 0,04 0,014 ng/ml volt, ami alacsony szisztémás expozíciót jelez. Bár ezek a koncentrációk emelkedést jelentettek az egyszeri adagot követően tapasztaltakhoz képest, az 1.és 7. napon a görbe alatti terület (AUC) értékei változatlanok voltak, ami arra utal, hogy többszörös adagolás esetén a szisztémás felszívódás nem növekszik. Az epinasztin 64% – ban kötődik a plazmafehérjékhez. A teljes szisztémás clearance körülbelül 56 L / óra, a terminális plazma eliminációs felezési idő pedig körülbelül 12 óra. Az epinasztin főként változatlan formában ürül. Az intravénás adag körülbelül 55% – a változatlan formában nyerhető vissza a vizeletben, körülbelül 30% – a a székletben. Kevesebb, mint 10% metabolizálódik. A renális elimináció főként aktív tubuláris szekréció útján történik.
nem klinikai toxikológia
karcinogenezis, mutagenezis, fertilitás romlása
egereken, illetve patkányokon végzett 18 hónapos, illetve 2 éves étrendi karcinogenitási vizsgálatokban az epinasztin nem volt karcinogén 40 mg/kg-ig terjedő dózisokban .
Az újonnan szintetizált tételekben az Epinasztin mutagenitás szempontjából negatív volt az Ames/Salmonella vizsgálatban és in vitro kromoszóma aberrációs vizsgálatban humán limfociták alkalmazásával. Pozitív eredményeket figyeltek meg az epinasztin korai adagolásakor két in vitro kromoszóma-aberrációs vizsgálatban, amelyeket 1980-as években humán perifériás limfocitákkal, illetve V79 sejtekkel végeztek. Az epinasztin negatív volt az in vivo klasztogenitási vizsgálatokban, beleértve az egér micronucleus assay-t és a kínai hörcsögök kromoszóma aberrációs vizsgálatát. Az epinasztin negatív volt a szíriai hörcsög embriósejteket alkalmazó sejttranszformációs vizsgálatban, a V79/HGPRT emlős sejtpont mutációs vizsgálatban, valamint in vivo / in vitro nem tervezett DNS-szintézis vizsgálatban patkány primer hepatocyták alkalmazásával.
az Epinasztin nem volt hatással hím patkányok fertilitására. Nőstény patkányokban csökkent fertilitást figyeltek meg az MROHD körülbelül 90 000-szeresének megfelelő orális dózis mellett.
klinikai vizsgálatok
az epinasztin HCl 0,05% szignifikánsan jobbnak bizonyult a vivőanyagnál a szemviszketés javításában allergiás conjunctivitisben szenvedő betegeknél két különböző modellt alkalmazó klinikai vizsgálatokban: (1) conjunctival antigen challenge (CAC), ahol a betegeket adagolták, majd antigént kaptak az inferior conjunctivalis fornixbe; és (2) környezeti terepi vizsgálatok, ahol a betegeket természetes élőhelyükön allergiás időszakban adagolták és értékelték. Az eredmények azt mutatták, hogy a 0,05% – os epinasztin-HCl gyorsan hat a conjunctival antigen challenge után 3-5 percen belül. A hatás időtartama 8 óra volt, így a napi kétszeri adagolás megfelelő. Ez az adagolási rend legfeljebb 8 hétig biztonságosnak és hatásosnak bizonyult, tachyphylaxisra utaló jelek nélkül.
hogyan szállítva / tárolás és kezelés
Epinasztin HCl szemészeti oldat 0.A 05% steril, átlátszatlan fehér LDPE műanyag palackokban, cseppentő hegyekkel és fehér polipropilén (PP) kupakkal van ellátva, az alábbiak szerint:
| 5 mL 10 mL – es palackban | NDC 51991-836-75 |
Tárolás: Tárolás: 20 (68) – 77 (F). A palackot jól lezárva, gyermekektől elzárva kell tartani.
Betegtanácsadási információk
a cseppentő hegy sterilitása
a betegeknek azt kell tanácsolni, hogy ne érjenek semmilyen felülethez, mert ez beszennyezheti a készítmény tartalmát (lásd figyelmeztetések és óvintézkedések, 5.1).
kontaktlencsék egyidejű alkalmazása
a betegeknek azt kell tanácsolni, hogy ne viseljenek kontaktlencsét, ha a szemük vörös. A betegek figyelmét fel kell hívni arra, hogy az epinastine HCl 0,05%-os szemészeti oldat nem alkalmazható kontaktlencsével összefüggő irritáció kezelésére. A betegeknek azt is tanácsolni kell, hogy az epinastine HCl szemészeti oldat 0,05% – os becseppentése előtt távolítsák el a kontaktlencséket.
a 0,05% – os Epinasztin HCl szemészeti oldatban lévő tartósítószer, a benzalkónium-klorid, lágy kontaktlencsékkel felszívódhat. A lencséket az Epinastine HCl szemészeti oldat beadását követő 10 perc elteltével vissza lehet helyezni 0,05%
csak helyi szemészeti alkalmazásra
csak helyi szemészeti alkalmazásra.
csak Rx
forgalmazza:
Breckenridge Pharmaceutical, Inc.
Berlin, CT 06037
gyártó:
PrimaPharma, Inc.
San Diego, CA 92121
Rev: 04/2020
2323 04/20
PRINCIPAL DISPLAY PANEL – 5 mL Bottle Carton
NDC 51991-836-75
Epinastine HCl
Ophthalmic
Solution,
0.05%
FOR USE IN THE
EYES ONLY
sterile
Rx Only
5 mL sterile
breckenridge
A Towa
Company

| EPINASTINE HYDROCHLORIDE epinastine hydrochloride solution/ drops |
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
Labeler – Breckenridge Pharmaceutical, Inc. (150554335)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| PrimaPharma, Inc. | 079699106 | MANUFACTURE(51991-836) | |
További információ az epinasztin szemészeti
- mellékhatások
- terhesség vagy szoptatás alatt
- adagolási információk
- árképzés & kuponok
- Angolul
- 3 vélemény
- kábítószer osztály: szemészeti antihisztaminok és dekongesztánsok
fogyasztói források
- betegtájékoztató
- Epinasztin szemészeti (haladó olvasás)
szakmai források
- alkalmazási információk
- Epinasztin (szakmai Betegtanácsadás)
egyéb márkák Elestat
kapcsolódó kezelési útmutatók
- conjunctivitis, allergiás
orvosi nyilatkozat