kémiai kinetika
kémiai kinetika
lehet, hogy ismeri azokat a sav-bázis titrálásokat, amelyek fenolftaleint használnak végpontmutatóként. Lehet, hogy nem vette észre, azonban, mi történik, ha a megoldásamely fenolftaleint tartalmaz a felesleges bázis jelenlétében, néhány percig állni hagyjuk. Bár az oldat kezdetben rózsaszín színű, fokozatosan színtelenné válika fenolftalein erősen bázikus oldatban reagál az OH – ionnal.
az alábbi táblázat azt mutatja, hogy mi történik a fenolftaleinin-oldat koncentrációjával, amely kezdetben 0,005 m volt fenolftaleinben és 0,61 M OH-ionban. Amint láthatja, amikor ezeket az adatokat az alábbi grafikonon ábrázoljuk, a fenolftalein-koncentráció körülbelül négy perc alatt 10-szeresére csökken.
Experimental Data for the Reaction Between Phenolphthalein and ExcessBase
| Concentration of Phenolphthalein (M) |
Time (s) | |
| 0.0050 | 0.0 | |
| 0.0045 | 10.5 | |
| 0.0040 | 22.3 | |
| 0.0035 | 35.7 | |
| 0.0030 | 51.1 | |
| 0.0025 | 69.3 | |
| 0.0020 | 91.6 | |
| 0.0015 | 120.4 | |
| 0.0010 | 160.9 | |
| 0.00050 | 230.3 | |
| 0.00025 | 299.6 | |
| 0.00015 | 350.7 | |
| 0.00010 | 391.2 |
az olyan kísérletek, mint amilyenek a fenti táblázatban szereplő adatokat adták nekünk, a kémiai kinetika mérésének minősülnek (egy görög szárból, ami azt jelenti, hogy “tomove”). Ezeknek a kísérleteknek az egyik célja a reakciósebesség leírásaa reagensek reakciótermékekké alakulnak át.
a kifejezés arány gyakran használják a mennyiség változásaami időegységenként történik. Az infláció mértéke például aa standard tételek gyűjteményének átlagos költsége évente. Az a sebesség, amellyel egy objektumutazik az űrben, az időegységenként megtett távolság, például mérföld / óra vagykilométer másodpercenként. A kémiai kinetikában a megtett távolság aa reakció egyik összetevőjének koncentrációja. A reakció sebessége tehát az egyik reagens koncentrációjának változása![]() (X)
(X)![]() ami egy adott időtartam alatt következik be
ami egy adott időtartam alatt következik be![]() t.
t.
![]()
1. gyakorlati probléma:
használja a fenti táblázat adatait annak kiszámításához, hogy a fenolftalein milyen sebességgel reagál az oh – ionnal a következő időszakok mindegyikében:
(a) az első időintervallumban, amikor a fenolftalein koncentrációja 0,0050 m-ről 0,0045 m-re csökken.
(b) a második intervallum alatt, amikor a koncentráció 0,0045 M-ről 0,0040 m-re esik.
(c) a harmadik intervallum alatt, amikor a koncentráció 0,0040 M-ről 0,0035 m-re esik.
kattintson ide az 1. gyakorlati problémára adott válasz ellenőrzéséhez.
kattintson ide az 1.probléma megoldásának megtekintéséhez.
![]()
a reakció pillanatnyi sebessége és a reakció arányszáma
a fenolftalein és az OH-ion közötti reakció sebessége nem állandó; idővel változik. Mint a legtöbb reakció, ennek a reakciónak a sebességefokozatosan csökken, amikor a reagenseket fogyasztják. Ez azt jelenti, hogy a reakció sebességeváltozik a mérés közben.
a méréseinkbe bevitt hiba minimalizálása érdekében úgy tűnik, hogy tanácsos a reakció sebességét rövid ideig mérni, összehasonlítva a reakció bekövetkezéséhez szükséges idővel. Megpróbálhatjuk például mérni a koncentráció végtelenül kis változását![]() d(X)
d(X)![]() ami végtelenül rövid idő alatt következik be. Ezek arányaa mennyiségeket a reakció pillanatnyi sebességének nevezik.
ami végtelenül rövid idő alatt következik be. Ezek arányaa mennyiségeket a reakció pillanatnyi sebességének nevezik.
![]()
a reakció pillanatnyi sebessége bármely pillanatban kiszámíthatóa reagens (vagy termék) koncentrációjának grafikonjáról az idő függvényében. Az alábbi grafikon azt mutatja, hogy a fenolftalein bomlásának reakciósebessége hogyan számítható ki a koncentráció és az idő grafikonjából. A reakció sebessége bármelyik pillanatbanaz idő megegyezik az adott görbére húzott érintő meredekségével.
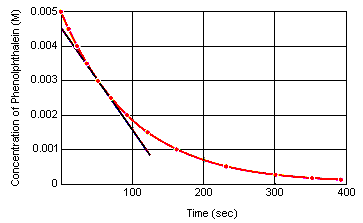
a reakció pillanatnyi sebessége bármikor mérhető a reagensek keveredése és a reakció egyensúlyba kerülése között.Ezeknek az adatoknak az extrapolálása arra a pillanatra, amikor a reagenseket összekeverik, megadja a kezdeti azonnali reakciósebességet.
![]()
Sebességtörvények és Sebességállandók
érdekes eredmény érhető el, ha a pillanatnyi reakciósebességet a görbe különböző pontjain számítják ki az előző szakasz grafikonján. A reakció sebessége a görbe minden pontján közvetlenülarányos a fenolftalein koncentrációjához abban a pillanatban.
sebesség = k (fenolftalein)
mivel ez az egyenlet egy kísérleti törvény, amely leírja a reakció sebességét, ezt a reakció sebességtörvényének nevezzük. Az arányosságállandó, k, sebességállandónak nevezik.
2.gyakorlati probléma:
Számítsa ki a fenolftalein és az OH – ion közötti reakció sebességállandóját, ha a reakció pillanatnyi sebessége 2.5 x 10-5 mol / liter / másodperc, ha a fenolftalein koncentrációja 0,0025 M.
kattintson ide, hogy ellenőrizze a 2.gyakorlati problémára adott választ.
kattintson ide a 2.probléma megoldásának megtekintéséhez.
3.gyakorlati probléma:
használja a sebességállandót a fenolftalein és az OH – ion közötti reakcióhoz az előző táblázatban felsorolt kísérleti adatok kezdeti pillanatnyi reakciósebességének kiszámításához.
kattintson ide, hogy ellenőrizze a 3.Gyakorlati problémára adott választ.
kattintson ide a 3.probléma megoldásának megtekintéséhez.
![]()
a reakciósebesség kifejezésének különböző módjai
a reakció sebességének mérésére általában több módszer is létezik. Tanulmányozhatjuk a hidrogén-jodid bomlását, például a sebesség mérésévelamely vagy H2 vagy I2 a következő reakcióban vagy therátban képződik, amelyen a HI-t fogyasztják.
2 HI(g) H2(g) + I2 (g)
kísérletileg azt találjuk, hogy az I2 kialakulásának sebességearányos a HI koncentráció négyzetéhez bármely pillanatban.
![]()
mi történne, ha tanulmányoznánk a H2 kialakulásának sebességét?A kiegyensúlyozott egyenlet azt sugallja, hogy H2 és I2 pontosan azonos sebességgel kell kialakulni.
![]()
mi történne azonban, ha tanulmányoznánk a HI fogyasztásának sebességétebben a reakcióban? Mivel a HI fogyasztódik, a koncentráció változásának anegatív számnak kell lennie. Egyezmény szerint a reakció sebességét mindig pozitívnak kell jelenteniszámot. Ezért meg kell változtatnunk a jelet, mielőtt bejelentenénk a reakció során felhasznált areaktáns reakciósebességét.
![]()
a negatív jel két dolgot tesz. Matematikailag negatívat alakít áta HI koncentrációjának változása pozitív arányra. Fizikailag emlékeztet arra, hogy aa reagens koncentrációja idővel csökken.
milyen összefüggés van a H2 vagy I2 képződésének figyelemmel kísérésével kapott reakciósebesség és a HI eltűnésének figyelésével kapott sebesség között? A reakció sztöchiometriája szerint két HI molekula vanfogyasztott minden előállított H2 vagy I2 molekulára. Ez azt jelenti, hogy a HI bomlási sebessége kétszer olyan gyors, mint a H2 és az I2A képződés sebessége. Ezt a kapcsolatot matematikai egyenletre fordíthatjuk az alábbiak szerint.
![]()
ennek eredményeként a H sebességének tanulmányozásából kapott sebességi állandó2és I2 képződnek ebben a reakcióban (k) nem ugyanaza sebességi állandó, amelyet a HI fogyasztásának sebességének figyelemmel kísérésével kapunk (k’)
gyakorlati probléma 4:
Számítsa ki azt a sebességet, amellyel a HI eltűnik a következő reakcióban abban a pillanatban, amikor az I2 1,8 x 10-6 mol/liter/másodperc sebességgel alakul ki:
2 HI(g) ![]() H2(g) + I2(g)
H2(g) + I2(g)
kattintson ide, hogy ellenőrizze a 4.gyakorlati problémára adott választ.
kattintson ide a 4.probléma megoldásának megtekintéséhez.
![]()
a sebesség törvény Versus sztöchiometria aReaction
az 1930-as években Sir Christopher Ingold és munkatársai a University ofLondon tanulmányozta a kinetikája szubsztitúciós reakciók, mint például a következő.
CH3Br(aq) + OH-(AQ)
CH3OH(AQ) + br-(AQ)
azt találták, hogy a reakció sebessége arányos mindkét reagens koncentrációi.
Rate = k(CH3Br) (OH-)
amikor hasonló reakciót futtattak egy kissé eltérő kezdetenanyag, hasonló termékeket kaptak.
(CH3) 3CBr(aq) + OH-(AQ)![]() (CH3) 3COH(aq) + Br-(AQ)
(CH3) 3COH(aq) + Br-(AQ)
de most a reakció sebessége arányos volt csak az egyik reagens koncentrációjával.
Rate = k ((CH3)3CBr)
Ezek az eredmények egy fontos pontot szemléltetnek: a reakció sztöchiometriájából nem lehet megjósolni a areakció sebességtörvényét; meg kell határoznikísérletileg. Néha a sebességtörvény összhangban van azzal, amit elvárunka reakció oichiometriája.
2 HI(g) H2(g) + I2(g)
Rate = k(HI)2
Often, however, it is not.
| 2 N2O5(g) |
Rate = k(n2o5) |
![]()
a molekularitás sorrendje
néhány reakció egyetlen lépésben történik. Az a reakció, amelyben egy klóratomot átviszünk a ClNO2-ból NO-ba, hogy NO2-t és ClNO-t képezzünk, jó példa az egylépéses reakcióra.
ClNO2(g) + NO(g)
NO2(g) + ClNO(g)
Other reactions occur by a series of individual steps. N2O5,for example, decomposes to NO2 and O2 by a three-step mechanism.
| Step 1: | N2O5 |
|
| 2.lépés: | NO2 + NO3 |
|
| 3. lépés: | no + no3 |
a reakció lépéseit MOLEKULARITÁS szerint osztályozzuk,amely leírja az elfogyasztott molekulák számát. Amikor egyetlen molekulát fogyasztanak, a lépést unimolekulárisnak nevezzük. Amikor két molekula vanfogyasztott, bimolekuláris.
5.gyakorlati probléma:
határozza meg a reakció minden egyes lépésének molekularitását, amelynek során N2O5 bomlik NO2-re és O2-re.
kattintson ide az 5.gyakorlati problémára adott válasz ellenőrzéséhez.
kattintson ide az 5.probléma megoldásának megtekintéséhez.
a reakciók sorrendjük szerint is osztályozhatók. Az n2o5 dekompozíciója elsőrendű reakció, mert a reakció sebessége az n koncentrációjától függ2o5 az első teljesítményre emelve.
Rate = k (N2O5)
A HI bomlása másodrendű reakció, mivel a reakció sebessége a második teljesítményre emelt HI koncentrációjától függ.
Rate = k (HI)2
Ha a reakció sebessége több mint egytől függagens, a reakciót az egyes reagensek sorrendjében osztályozzuk.
6. gyakorlati probléma:
osztályozza a NO és O2 közötti reakció sorrendjét NO2-ként:
2 NO (g) + O2 (g) ![]() 2 NO2 (g)
2 NO2 (g)
tegyük fel a következő sebességtörvényt erre a reakcióra:
Rate = k(NO)2(O2)
kattintson ide, hogy ellenőrizze a választ a gyakorlatban probléma 6.
a molekularitás és a reakció sorrendje közötti különbség fontos. A reakció molekularitása, vagy a reakcióon belüli lépés leírja,mi történik molekuláris szinten. A reakció sorrendje leírja, mia makroszkopikus skálán történik. A reakció sorrendjét úgy határozzuk meg, hogy megfigyeljük aa reakció termékei megjelennek, vagy a reagensek eltűnnek. A molekularitás a reakcióvalamit arra következtetünk, hogy megmagyarázzuk ezeket a kísérleti eredményeket.
![]()
a kémiai reakciók Ütközéselméleti modellje
a kémiai reakciók ütközéselméleti modellje felhasználható a megfigyelt sebességtörvények magyarázatára mind az egylépéses, mind a többlépcsős reakciók esetében. Ez a modell feltételezi, hogy a reakció bármely lépésének sebessége az adott lépésben részt vevő részecskék közötti ütközések gyakoriságától függ.
az alábbi ábra alapul szolgál az ütközéselméleti modell következményeinek megértéséhez az egyszerű, egylépéses reakciókhoz, például a következőkhöz.
ClNO2(g) + NO(g) ![]() NO2(g) + ClNO(g)
NO2(g) + ClNO(g)

a kinetikus molekuláris elmélet feltételezi, hogy a gázban üldözött ütközések száma a literenkénti részecskék számától függ. A reakció során az NO2 és a ClNO képződésének sebességének tehát egyenesen arányosnak kell lennie mind a ClNO2, mind a NO koncentrációival.
Rate = k (ClNO2) (NO)
az ütközéselméleti modell azt sugallja, hogy az areaction bármely lépésének sebessége arányos az adott lépésben felhasznált reagensek koncentrációjával. Ezért az egylépéses reakció teráttörvényének egyet kell értenie a reakció sztöchiometriájával.
a következő reakció például egyetlen lépésben történik.
CH3Br(aq) + OH-(AQ) ![]() CH3OH(aq) + Br-(AQ)
CH3OH(aq) + Br-(AQ)
amikor ezek a molekulák ütköznek a megfelelő tájolásban, az OH – ionon egy pár nem kötődő elektront adhatunk a ch3br molekula központjában lévő szénatomnak, amint az az alábbi ábrán látható.

amikor ez megtörténik, szén-oxigén kötés alakul ki, miközben a szén-bróm kötés megszakad. Ennek a reakciónak a nettó eredménye az anOH-ion helyettesítése egy Br-ionnal. Mivel a reakció egyetlen lépésben következik be, amely a két reagens ütközésével jár, ennek a reakciónak a sebessége mindkét reagens koncentrációjához viszonyítva arányos.
Rate = k(CH3Br) (OH-)
nem minden reakció fordul elő egyetlen lépésben. A következő reakció fordul előhárom lépés, amint az az alábbi ábrán látható.
(CH3)3CBr(aq) + OH-(AQ)![]() (CH3)3COH(aq) + Br-(AQ)
(CH3)3COH(aq) + Br-(AQ)

az első lépésben a (CH3)3CBr molekulaiegy pár ionra oszlik.
| első lépés |  |
a pozitív töltésű (CH3)3C+ ion a második lépésben vízzel reagál.
| második lépés |  |
ennek a reakciónak a terméke elveszíti a protont az Oh-ion vagy a víz számára az utolsó lépésben.
| harmadik lépés |  |
a reakció második és harmadik lépése sokkal gyorsabb, mint az első.
| (CH3)3CBr |
Slow step | |
| (CH3)3C+ + H2O |
Fast step | |
| (CH3)3COH2+ + OH- |
Fast step |
The overall rate of reaction is therefore more or less equal to the rateof the first step. Az első lépést ezért sebességkorlátozó lépésnek nevezzük ebben a reakcióban, mert szó szerint korlátozza a reakció termékeinek sebességétképződhetnek. Mivel csak egy reagens vesz részt a sebességkorlátozó lépésben, a reakció teljes aránya arányos csak ennek a reagensnek a koncentrációjával.
Rate = k ((CH3)3CBr)
ennek a reakciónak a sebességtörvénye tehát eltér attól, amit a reakció sztöchiometriájából megjósolnánk. Bár a reakció mindkettőt fogyasztja(CH3)3CMÁRKA OH-, a reakció sebessége csak arányos a (CH3)3cbr koncentrációjával.
a kémiai reakciók sebességtörvényei a következőkkel magyarázhatókáltalános szabályok.
a reakció bármely lépésének sebessége egyenesen arányos az adott lépésben felhasznált reagensek koncentrációjával.
a reakció teljes sebességtörvényét a lépések sorrendje vagy az a mechanizmus határozza meg, amellyel a reagenseket a reakció termékeivé alakítják.
a reakció teljes sebességtörvényét a reakció leglassabb lépésének sebességtörvénye uralja.
