határozza meg a molekula leginkább savas H
módszeres megközelítés működik a legjobban. Egyszerűen fogalmazva, meg kell vizsgálnia a molekulát savas funkcionális csoportok szempontjából, majd rangsorolnia kell ezeknek a csoportoknak a reaktivitását. A legsavasabb funkcionális csoport általában a legsavasabb H-t tartja az egész molekulában.
a” Scan and rank ” egyszerűen hangzik, de számos nehézséget rejt magában, amelyeket az alábbiakban részletezünk.
egy molekula vizsgálata ismert savas funkciós csoportok után
a savas protonok általában O-hoz vagy N-hez kötődnek. Ezért az első lépés az összes OH és NH kötés keresése.
az OH és az NH kötések megtalálásakor azonban el kell döntenie, hogy ezeket a kötött atomokat a szomszédos atomokkal rendelkező funkcionális csoportba kell-e csoportosítani.
a funkcionális csoport azonosításának egyetlen kényelmes módja az, hogy már ismerünk néhányat. Például, ha tudod, hogy a ROH, az RCO2H és az RSO3H gyakori savas funkciós csoportok, akkor nem lesz gond a savas csoportok megtalálásával a következő molekulában (a megfelelő csoportok pirossal vannak jelölve).
külön rangsorolja az OH-t és az NH-savakat
a közönséges OH-és NH-savak pKa-értékei széles tartományokat ölelnek fel, és azok tartományai átfedik egymást. A rangsor gyorsabban halad, ha az OH és az NH savakat külön rangsorolja, majd összehasonlítja az egyes kategóriák legjobb jelöltjeit.
a savas csoportok rangsorolásának legkényelmesebb módja az, hogy már ismerjük jellemző pKa-értékeiket. Ha ismeri ezeket az értékeket a molekula összes savas csoportjára, akkor a legalacsonyabb pKa-val rendelkező csoport tartalmazza a leginkább savas H-T.
Ha nem emlékszik a PKA értékekre az összes savas csoportra, néhány általános elv vezérelheti Önt.
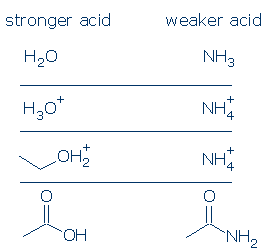
# 1 fontosság-a pozitív töltésű savak erősebbek, mint a semleges savak. A negatív töltésű savak ritkán savasak. Ha összehasonlítja a közönséges OH-savak pKa-értékeit, látni fogja, hogy a ROH2+ savak (amelyek magukban foglalják a H3O+ és az R2OH+) jelentősen erősebbek, mint a semleges savak, mint például az RCO2H, a PhOH és a ROH. Az egyetlen semleges sav, amely erősebb, mint a ROH2+, a H2SO4 és bizonyos más RSO3H.
a formális töltési szabály még erősebben vonatkozik az NH savakra. A H3O+ és H2O közötti pKa-különbség 18 egység, míg az NH4+ és NH3 közötti PKA-különbség gigantikus 26 egység.
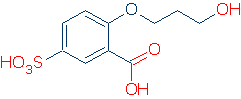
# 2 fontosság – keresse meg az aktiváló csoportokat, beleértve az RSO2 – t, az RC=O-t és a pH-t.az alábbi ábra azt mutatja, hogy az egyes atomcsoportok hogyan aktiválnak egy OH-savat (a pKa értékek 16-tól -2-ig terjednek):
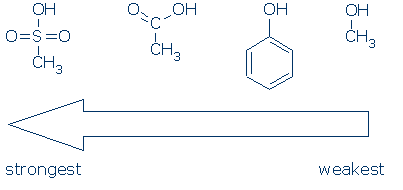
a CH3 nézői csoportnak számít, bárhol is jelenik meg ezekben a molekulákban. Nem poláros, nem fejt ki jelentős mezőinduktív hatást, és képtelen a töltés delokalizálására. Következésképpen lehetséges a CH3 helyettesítése más nézőcsoportokkal (például H és más R) anélkül, hogy a reaktivitást nagymértékben befolyásolnánk.
két további pontot kell tenni az aktiváló csoportokkal kapcsolatban.
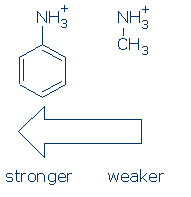
először is, a csoportok hasonló hatást gyakorolnak az NH savakra (és az aktiváló szekvencia ugyanaz: RSO2 > RC=O > Ph). Amint ez megtörténik, csak meg kell tanulnia a Ph hatását az NH+ – ra ezen a kurzuson:
másodszor, az aktiváló csoportokat közvetlenül az OH (vagy NH) csoporthoz kell kötni annak aktiválásához. A következő vegyületek hasonló pKa-értékekkel rendelkeznek, mivel az aktiváló csoportok nem kapcsolódnak közvetlenül az OH-hoz: CH3C(=O)CH2OH, PhCH2OH és CH3CH2OH.
# 3 fontosság – minden dolog egyenlő, egy OH sav savasabb, mint egy NH sav. Ez az elv nagyon hasznos lehet, ha megfelelően használják. Aggodalmam az, hogy megérted, mit jelent az, hogy “minden dolog egyenlő.”Ez azt jelenti, hogy az O-nak és az N-nek ugyanazzal a formális töltéssel kell rendelkeznie (1.tétel), és ugyanahhoz az aktiváló csoporthoz kell kapcsolódnia (2. tétel). A nézőcsoportok közötti különbségek azonban nem számítanak.
néhány érvényes összehasonlítás a következőket tartalmazza:
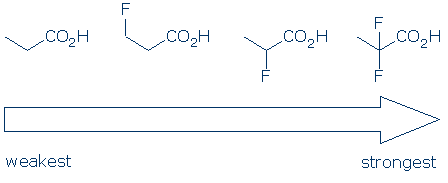
#4 fontosság – egy funkcionális csoport kategórián belül használjon szubsztituens hatásokat a savak összehasonlításához. Az elektronegatív szubsztituensek általában növelik a funkcionális csoport savasságát a mező és az induktív hatások kombinációjával. Ezek a hatások fokozódnak, ha 1) A szubsztituens közelebb helyezkedik el a savas csoporthoz, és 2) több szubsztituens van. Ezen elvek alapján arra számítunk, hogy ezen karbonsavak savassága ezt a tendenciát követi: