Sir、
皮膚の扁平上皮癌(SCC)は、西ヨーロッパでは年間30人あたり100,000人の発生率を持つ、頻繁な悪性皮膚腫瘍です。 日当たりの良い気候では、彼らはさらに頻繁になります。 SCCは通常、光線性角化症から発症する。 日光に加えて、他の素因となる要因には、電離放射線、瘢痕化を伴う慢性炎症、ウイルス感染および免疫抑制が含まれる。 臓器移植患者は、免疫抑制療法のために、SCCを発症するリスクが著しく増加しており、おそらく200倍である(1)。 同じことが原因で他の要因に免疫不全患者、例えば、HIV感染を有するものにも当てはまります(1、2)。
ケースレポート
50歳の男性は、過去3ヶ月にわたって開発していた彼の左頬に大きな腫瘍を提示しました。 腫ようは隆起した境界と中央の穿孔した潰瘍を有していた。 彼は6ヶ月前に多くの太陽にさらされてチュニジアに旅行していました。 彼はFitzpatrickの皮膚タイプIIを持っていたが、彼は日焼け止めを練習したことがなかった。 臨床検査では光線損傷の徴候は認められず,特に光線性角化症は認められなかった。 チュニジア滞在以来、患者は慢性の乾いた咳もしていた。 頚部リンパ節は触診と超音波検査で正常であった。 磁気共鳴断層撮影では隣接する軟部組織構造の浸潤は認められなかった。 腫ようの急速な増殖と巨視的な外観のために,角化腫を疑った。 組織学的検査では高分化型だが潰よう性SCCを認めた。 末梢T細胞のフローサイトメトリー分析は、唯一の5CD4+/CD3+-細胞と226CD8+/CD3+細胞(比0.02)、免疫不全を示し、おそらく腫瘍の急速な成長を説明する不均衡を明 潜在的に根底にある免疫抑制性疾患についての広範なカウンセリングにもかかわらず、患者はさらなるHIV診断手順を拒否し、咳(Pneumocystis jiroveci肺炎の疑い)を明確にし、転移を排除するための追加の研究も拒否した。 彼はまた、より広いマージンで再切除を拒否し、医師の助言に反して病院を去った。

図。 1. 大きな腫瘍を持つ50歳の男性の左頬。 (a)背側および(b)側方の側面。
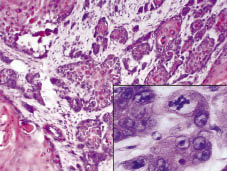
図。 2. 組織学的検査では,病変の解剖学的構造を破壊し,深い浸潤性腫ようを認めた。 挿入:腫瘍は、いくつかの有糸分裂を有する多形性ケラチノサイトで構成されている(H&E×200、デジタル倍率)。p>
ディスカッション
ケラトアカントーマ(KA)は、1889年にジョナサン-ハッチンソンによって顔面のcrateriform潰瘍として初めて記載されました。 これは、最も頻繁に太陽にさらされた領域(上の急速に成長している皮膚腫瘍として提示3)。 男性は女性よりも約3倍頻繁に影響を受けます。 調整された年齢分布は、それが中年で最も頻繁であり、(基底細胞癌およびSCCとは異なり)高齢者の発生率が増加しないことを示している(4)。 SCCが表面の上皮から成長する間、kasはsebaceous管が入るところでちょうど上の毛小胞の壁から得られます。 それらは、特定の臨床的および組織学的特徴を有する別個の実体である(5)。 自発的な退行の傾向と角化の広範な程度は、腫瘍の典型的な対称的なアーキテクチャ(とともに、最も顕著な特徴である6)。KAの正確なnosologyと分類は議論の問題です。
いくつかの著者は、KAを皮膚の”偽悪性”腫瘍のプロトタイプである良性皮膚腫瘍とみなしているが、他の著者は悪性新生物–SCCの特異な変種–であり、したがってSCC(7-9)のように扱われるべきであると主張している。 診断上の困難は、特に、巨大なKAまたは切断KAのような、kaの破壊的で持続的な変種に当てはまる。 臨床的には、KAは急速な成長の歴史と火山のような形によってSCCと区別されます。 しかし,ここで述べた症例では,HIV感染のために大きなSCCも非常に急速な成長を示した。 時には、kasとみなされる病変は、その後の臨床経過に基づいてSccとして再分類されなければならない。 誤った診断に加えて、他の説明は、KAとSCCの組み合わせだけでなく、KAからSCCへの変換です。 さらに、いくつかのKasは、Ackerman(1 0−1 2)によって提案されているように、sccの高分化型変異体であり得る。
KAとSCCを区別することが困難であるため、すべてのタイプのKAsに対して選択される治療は、診断の病理組織学的検証を伴う外科的切除である(8-10)。 手術が不可能な場合は、電離放射線を考慮することができます。 局所5-フルオロウラシル、インターフェロン-α、メトトレキサート、またはブレオマイシンの病変内注射および全身投与されたレチノイドなどのいくつかの他の治療選択肢は、個々の症例において有効であることが報告されているが、これらの治療の効率を示す対照臨床試験はない(1、4、5)。
いくつかのSccは、ここで説明した場合のように、KAを模倣して急速に成長する可能性があります。 KAsの急速な成長の理由は不明であり、免疫抑制および過度の日光への曝露を含むいくつかの仮説が提供されている。 Kas,特にSCCと明確に区別できないものは,転移の早期発症を伴う予後が悪い可能性があるため,広い外科的切除によって治療すべきである。
1. Sterry W,Stockfleth E.Maligne epitheliale Tumore. In:Braun-Falco O,Plewig G,Wolff HH,Burgdorf WH,Landthaler M,editors. Dermatologie und Venerologie. 第5回edn. ハイデルベルク:シュプリンガー、2005:p.1267-1276。
2. Nguyen P,Vin-Christian K,Ming ME,Berger T.ヒト免疫不全ウイルスに感染した人における積極的な扁平上皮癌。 アーチスト2002;138: 758–763.
3. Rinker MH、Fenske NA、Scalf LA、Glass LF。 皮膚の扁平上皮癌の組織学的変異体。 Cancer Control2 0 0 1;8:3 5 4−3 6 3.
4. マック-キークインAG. 非黒色腫の皮膚癌および表皮の皮の腫瘍。 で:バーンズT,ブレスナックS,コックスN,グリフィスC,編集者. ルークの皮膚科の教科書。 第7回edn. マサチューセッツ州:ブラックウェル科学、2004:p.43-46。
5. Kurschat P,Hess S,Hunzelmann N,Scharffetter-Kochanek K.keratoacanthoma遠心分離機marginatumは、広範な肉芽腫性異物反応を伴う。 2005年11月16日に発売された。
6. バイエル-ガーナー IB、イワンD、シュワルツ氏、Tschen JA。 良性苔癬様角化症、角化角腫およびハロー母斑における退行の免疫病理学。 Clin Med Res2004;2:89-97.
7. Cribier B,Asch P,Grosshans E.病理組織学的基準を用いて角化角腫から扁平上皮癌を分化させる。 それは可能ですか? 296例の研究。 皮膚科1999;199:208-212.
8. Beham A、Regauer S、Soyer HP、Beham-Schmid C.Keratoacanthoma:well differentiated squamous cell carcinomaの臨床的に明瞭な変形。 Adv Anat Pathol199;5:269-280.
9. ワーナー DM、フラワーズF、ラモス-カロFA。 孤立性角化腫(扁平上皮癌):外科的管理。 Int J Dermatol1 9 9 5;3 4:1 7−1 9。
10. Hodak E,Jones RE,Ackerman AB. 孤立性角化腫はへん平上皮癌であり,転移を伴う三つの例である。 Am J Dermatopathol1993;15:332-342.
11. Sanchez YE,Simon P,Requena L,Ambrojo P,de Eusebio E.孤立性角化角化腫:頻繁に悪性になる自己治癒増殖。 Am J Dermatopathol2000;22:305-310.
12. ローレンス-N-リード-RJ 光線性角化腫。 病変の性質およびその進化における細胞免疫の役割に関する推測。 Am J Dermatopathol1990;12:517-533.