双極子
非共有結合相互作用の性質を理解するためには、まず共有結合に戻り、双極子の主題を掘り下げなければならない。 私たちが見てきた共有結合の多くは、例えば2つの炭素の間、または炭素と水素の間で、結合中の2つの原子間の電子のほぼ等しい共有を伴います。 これらの例では、2つの原子はほぼ同じ電気陰性度を有する。 あなたの一般的な化学コースから、電気陰性度は”分子内の原子がそれ自体に電子を引き付ける力”を指していることを思い出してください(これは、私たちが学んできた結合概念の多くを開発する主に責任があった著名な20世紀のアメリカの化学者であるLinus Paulingによって提供された定義です)。
しかし、有機化学では、電気陰性度の異なる2つの原子間の共有結合を扱うことがよくあり、これらの場合、電子の共有は等しくありません。 例えば、アルコールの炭素-酸素結合では、シグマ結合の二つの電子は、酸素が炭素よりも著しく電気陰性であるため、炭素よりも酸素に密接に保持される。 水素は炭素よりも電気陰性度がわずかに低く、酸素よりも電気陰性度がはるかに低いため、酸素-水素結合にも同じことが当てはまります。p>
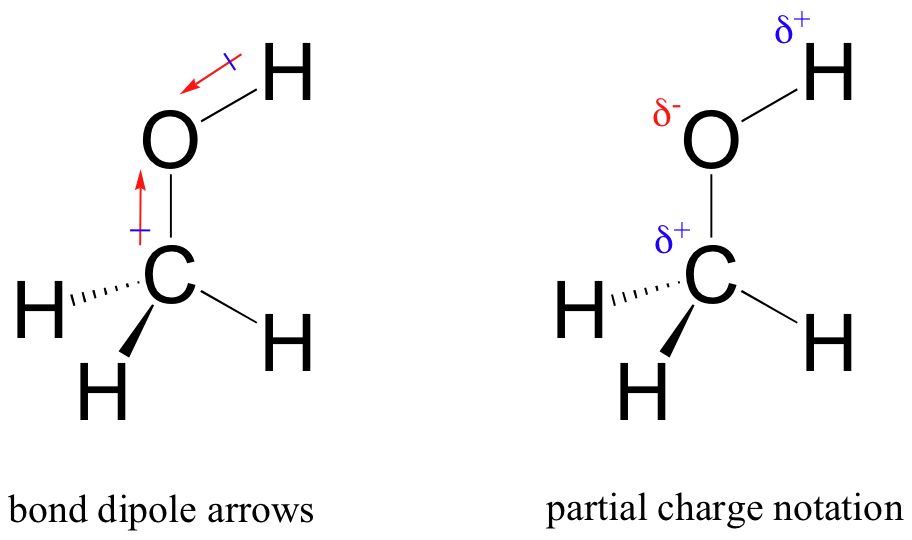
この不等な共有の結果は、極性共有結合に存在する結合双極子と呼ばれるものです。 結合双極子は、電子密度がより低い(正の極)およびより高い(負の極)負の端部または極の両方を有する。 電子密度の差は、原子上の”部分的な正”と”部分的な負”の電荷を示すためにギリシャ文字のデルタを使用して表現することができます。 尾部に正の符号を持つ’双極子矢印’は、双極子の負の(より高い電子密度)方向を示すためにも使用される。
共有結合における極性の程度は、2つの原子間の電気陰性度の差に依存する。
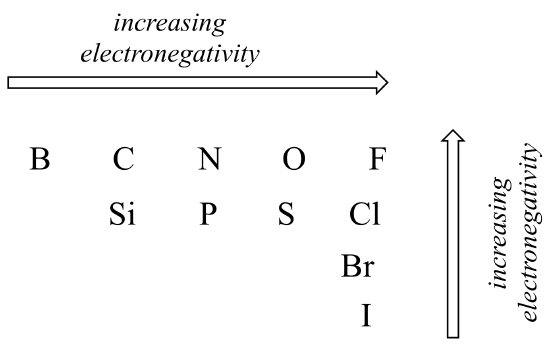
共有結合における極性の程度は、2つの原子間の電気陰性度 電気陰性度は周期的な傾向です:それは要素の周期表の行を横切って左から右に行くように増加し、我々は列を上に移動するとまた増加します。 したがって、酸素は窒素よりも電気陰性であり、これは炭素よりも電気陰性である。 酸素はまた、硫黄よりも電気陰性である。 フッ素は、周期表の右上隅にあり、元素の中で最も電気陰性である。 水素は炭素よりも電気陰性度がわずかに低い。P>
電気陰性度の周期的な傾向
運動2.26
原子軌道についてのものを使用して、電気陰性度の周期的な傾向を合理化します。 なぜそれは左から右に増加し、上から下に減少するのですか? これは、クラスメートやインストラクターや家庭教師と話をする良い質問です。ほとんどの分子は極性共有結合と非極性共有結合の両方を含んでいます。
練習への解決策
ほとんどの分子は極性共有結合と非極性共有結合の両方を含んでいます。 極性結合の位置や結合の幾何学的形状に応じて、分子は分子双極子モーメントと呼ばれる正味の極性を持つことがある。 水は、あなたがおそらく思い出すように、その2つの酸素-水素結合の結合された双極子から生じる双極子モーメントを持っています。 フルオロメタンには双極子モーメントもある。
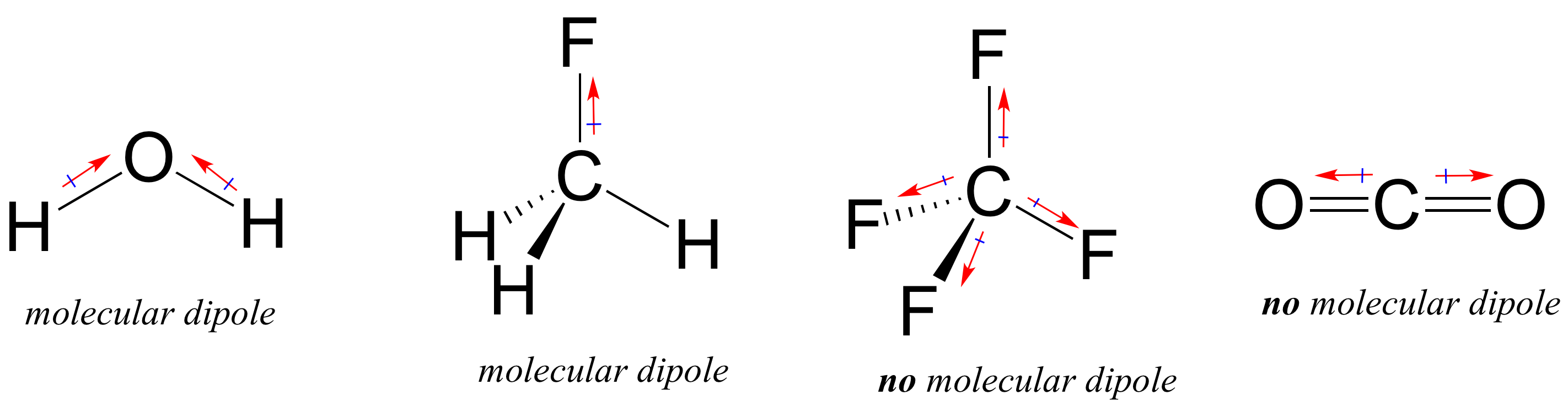
テトラフルオロメタンは、しかし、四つの結合双極子があるが、全体的な分子双極子モーメントがないことを意味し、四面体の四隅に均等に引っ張る四つの極性結合を持っています。 二酸化炭素はまた分子双極子モーメントを欠いている。
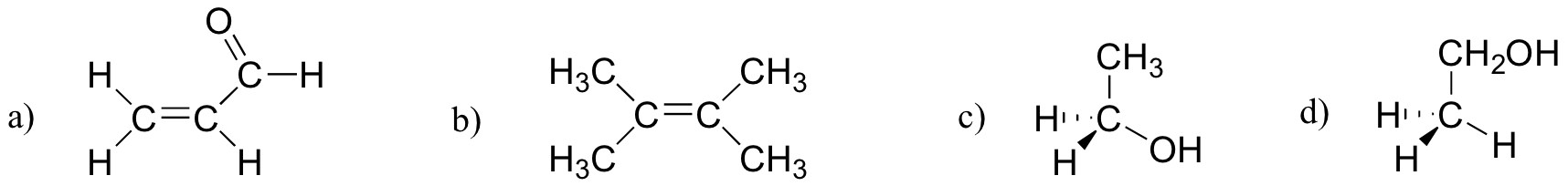
運動2.27
以下の分子のどれが分子双極子モーメントを持っていますか?p>
演習への解決策