Facts,Summary&Definition
- 付加物は付加反応によって形成される生成物である
- 付加物は、アルケンやカルボニル基などの多重結合を有する反応物からのみ形成することができる
- 付加物は、二つのタイプの付加反応によって形成することができる。求電子および求核
- 付加体は、多くの場合、ルイス酸とルイス塩基の間に形成されます
付加体とは何ですか?付加物は、付加反応の終わりに形成される生成物である。
付加物は、付加反応の終わりに形成される生成物である。
これは、二つ以上の分子が反応し、一つの大きな生成物を形成するために結合する反応である。 このタイプの反応は、アルケン(二重結合)とアルキン(三重結合)のような多重結合を有する化合物の間でのみ起こることができる。 カルボニル基(C=O)およびイミン基(C=N)も付加反応を起こし、付加体を形成することができる。
付加体はどのように形成されていますか?前に述べたように、付加体は付加反応を介して形成される。
このタイプの反応では、二重結合は、反応分子が攻撃して付加するときに部分的に破壊される。 以下の反応は、エテンと臭素との付加反応を示す。

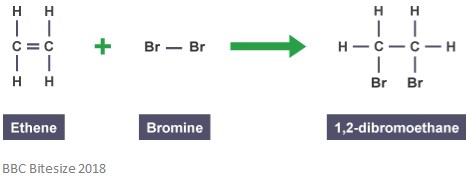
化にこの反応は1,2-dibromoethane. これは、すべての成分のすべての原子を含む別個の種であるためです。
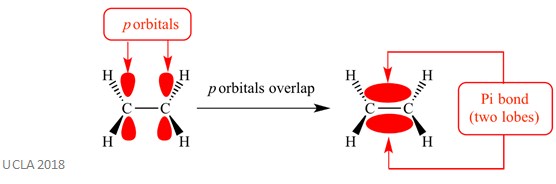
これらの付加反応は、通常、π(π)結合を含む。
これは、隣接する原子上のp軌道が重なり合う複雑なタイプの結合であり、pi結合を引き起こすのはこの重なり合いである。 これは、これら二つの同じ原子間の任意のシグマ結合に垂直に発生します。 一方はシグマ結合の平面上にあり、もう一方はシグマ結合の平面下にあります。 Pi結合は下の図に示されています。

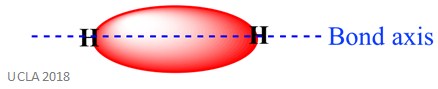
同じ反応にはシグマ(π)結合も含まれる可能性があります。 これは、結合軸に沿った原子軌道の重複による共有結合形態の一種である–言い換えれば、二つの結合原子を接続する線に沿って。 例えば、水素原子中のシグマ結合は、各水素原子から1つずつの2つの1s軌道の重なり合いによって形成される。 これは下の画像でよりよく示されています-赤い領域はシグマ結合を示しています。

主に2つのタイプの付加反応があります:求電子付加と求核付加。
求電子付加
求電子付加反応は、結合が破壊され、二つの新しい結合が形成される反応の一種である。 前述したように、反応物は二重結合または三重結合を持たなければならず、この場合、求電子剤はπ結合に追加される。 これは付加反応であるため、プロセスでは何も失われません–反応分子に見られるすべての原子は付加物にも見られます。

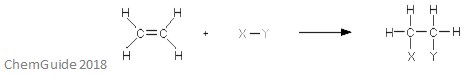
上の画像は、求電子付加反応の基本を示しています。 あなたが見ることができるように、反応物中の原子のすべてが付加物中に見出されます。
求核付加反応は、二重結合が壊れ、二つの単結合が形成される反応の一種である。
求核付加反応は、二重結合が破壊され、二つの単結合が形成 電子欠乏(求電子性)二重結合または三重結合は、電子に富む(求核性)ものと反応する。 求核剤は、この場合、pi結合に付加する。 求核付加反応の一例を以下に示す。

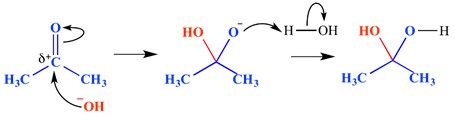
この例では、水酸化物イオンがカルボニル基のデルタ正の端に追加されました。 したがって、最終的な結果は、カルボニル基pi結合を横切って水を添加することである。
ルイス酸とルイス塩基
付加体は、ルイス酸とルイス塩基の間に形成されることがよく知られている。 形成された分子はルイス酸-塩基付加物(またはルイス酸-塩基複合体)と呼ばれる。 付加体は付加反応によってのみ形成されるため(すなわち、基の同時損失なしに)、ルイス酸およびルイス塩基反応は置換型の反応ではない。これの良い例は、下の画像に示されているTHFとBH3との間の反応です。
これの良い例は、下の画像に示されているTHFとBH3との間の反応です。 ご覧のように、これらのルイス酸-ルイス塩基付加体はドットで示されています–これらは電子を表しています。ご覧のとおり、形成される唯一の生成物はBH3-THF複合体であり、これは付加体であることを意味します。
これらのタイプの反応は、矢印で描くこともできます–これらの矢印は、塩基から酸への電子の供与を表します。 同じ反応が以下に示されているが、電子供与性を示すための矢印が付いている。ここでは、これらの矢印が尖った端に2つの「棘」を持っていることに注意することが重要です。 これは、一対の電子が寄贈されたことを示しています。 一つの電子だけが寄付された場合、矢印は尖った端に”一つの”吟遊詩人だけを持つことになります。この例では、ルイス酸はボランであり、ルイス塩基はTHFである。
この例では、ルイス酸はボランであり、ルイス塩基はTHFである。 あなたが見ることができるように、塩基は酸素-ホウ素結合を形成するために酸に孤立電子対を寄付しました。
分子の形状のために付加物を形成することができない化合物は、フラストレーションルイス対と呼ばれています。
さらに読む
http://www.chem.ucla.edu/~harding/IGOC/L/lewis_acid_base_adduct.html