分子の最も酸性のHを特定する
方法論的なアプローチが最も効果的です。 簡単に言えば、酸性官能基の分子をスキャンし、これらの基の反応性をランク付けする必要があります。 最も酸性の官能基は、通常、分子全体で最も酸性のHを保持しています。
“スキャンとランク”は簡単に聞こえますが、以下で詳述されているいくつかの困難を隠しています。
既知の酸性官能基のための分子をスキャン
酸性プロトンは、通常、OまたはNに結合しています。 したがって、最初のステップは、すべてのOHおよびNH結合を探すことです。しかし、OHとNH結合を見つけるときには、これらの結合原子を隣接する原子を持つ官能基に集中させるかどうかを決定する必要があります。
官能基を識別するための唯一の便利な方法は、すでにいくつかを知っていることです。 たとえば、ROH、RCO2H、およびRSO3Hが一般的な酸性官能基であることがわかっている場合、次の分子に酸性基を見つけるのに問題はありません(正しい基
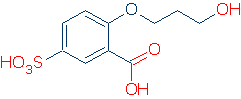
ランクOHとNH酸度を別々に
一般的なOHとNH酸のpKa値は広い範囲に及び、その範囲は重複しています。 OHおよびNH酸を別々にランク付けし、各カテゴリの上位候補を比較すると、ランキングはより迅速に進行します。
酸性基をランク付けする最も便利な方法は、それらの特徴的なpKa値を既に知ることです。 分子内のすべての酸性基についてこれらの値がわかっている場合、pKaが最も低いグループには最も酸性のHが含まれています。すべての酸性基のpKa値を覚えていない場合は、いくつかの一般的な原則があなたを導くことができます。
あなたは酸性基のpKa値を覚えていな
#1重要性-正に帯電した酸は中性の酸よりも強い。 負に帯電した酸はほとんど酸性ではありません。 一般的なOH酸のpKa値を比較すると、ROH2+酸(H3O+とR2OH+を含む)は、rco2H、PhOH、ROHなどの中性酸よりもかなり強いことがわかります。 ROH2+よりも強い唯一の中性酸は、H2SO4および特定の他のRSO3Hです。
正式な電荷規則は、NH酸にさらに強く適用されます。
正式な電荷規則は、NH酸にさらに強く適用されます。
正式な電荷規則は、NH酸に H3O+とH2Oの間のpKaの差は18単位であり、NH4+とNH3の間のpKaの差は巨大な26単位である。次の表は、原子の各グループがOH酸を活性化する方法を示しています(pKa値は16から-2の範囲):
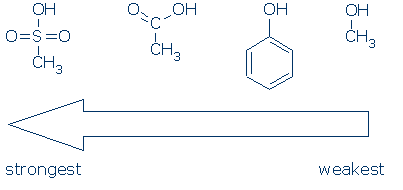
CH3は、これらの分子に現れる場所では観客グループと考えられています。 それは非極性であり、有意な電界誘導効果を発揮せず、電荷を非局在化することができない。 その結果、反応性に大きな影響を与えることなく、C H3を他の観客基(例えば、Hおよび他のR)と置換することが可能である。
活性化グループに関して二つの追加のポイントを行う必要があります。まず、基はNH酸に対して同様の効果を発揮する(活性化配列は同じである:RSO2>RC=O>Ph)。 それが起こるように、あなたはこのコースのためにNH+に対するPhの効果を学ぶ必要があります:第二に、活性化基は、それを活性化するために、OH(またはNH)基に直接結合されなければならない。 活性化基がOHに直接結合していないため、以下の化合物は同様のpKa値を有する:CH3C(=O)CH2OH、Phch2Oh、およびCH3CH2OH。 #3重要性-すべてのものが等しく、OH酸はNH酸よりも酸性です。
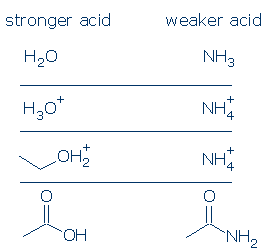
#3重要性-すべてのものが等しく、OH酸はNH酸よりも酸性です。 この原則は、適切に使用すると非常に便利です。 私の懸念は、「すべてのものが平等であること」が何を意味するのかを理解しているということです。 これは、OとNが同じ正式な電荷(項目#1)を持ち、同じ活性化基(項目#2)に結合しなければならないことを意味します。 しかし、観客グループの違いは重要ではありません。 p>
いくつかの有効な比較が含まれます:
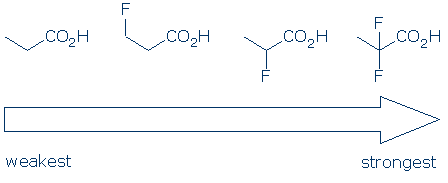
#4重要性-官能基カテゴリ内では、酸を比較するために置換基効果を使用します。 電気陰性置換基は、通常、場効果と誘導効果の組み合わせによって官能基の酸性度を高める。 これらの効果は、1)置換基が酸性基の近くに位置し、2)複数の置換基が存在する場合に増強される。 これらの原則を考えると、これらのカルボン酸の酸性度はこの傾向に従うことが期待されます。