El miocito cardiaco es el mayor de células que intervienen en la remodelación. Los fibroblastos, el colágeno, el intersticio y, en menor medida, los vasos coronarios también desempeñan un papel. Un escenario común de remodelación es después de un infarto de miocardio. Hay necrosis miocárdica (muerte celular) y adelgazamiento desproporcionado del corazón. Esta zona delgada y debilitada no puede soportar la presión y la carga de volumen en el corazón de la misma manera que el otro tejido sano. Como resultado, hay dilatación de la cámara derivadas de la región del infarto. La fase de remodelación inicial después de un infarto de miocardio resulta en la reparación del área necrótica y la cicatrización miocárdica que, en cierta medida, puede considerarse beneficiosa, ya que hay una mejora o mantenimiento de la función del VI y del gasto cardíaco. Sin embargo, con el tiempo, a medida que el corazón sufre una remodelación continua, se vuelve menos elíptico y más esférico. Aumento de la masa y el volumen ventriculares, que juntos afectan negativamente a la función cardíaca. Con el tiempo, la función diastólica, o la capacidad del corazón para relajarse entre contracciones, puede deteriorarse, causando aún más deterioro.
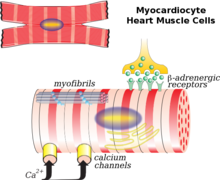
Después de un infarto de miocardio (IM), la muerte de los miocitos cardíacos puede desencadenarse por necrosis, apoptosis o autofagia, lo que lleva al adelgazamiento de la pared cardíaca. Los miocitos cardíacos sobrevivientes se disponen en paralelo o en serie entre sí, contribuyendo a la dilatación ventricular o a la hipertrofia ventricular, dependiendo del esfuerzo de carga en la pared ventricular. Además, se cree que la expresión reducida de la misoína V1 y de los canales de calcio de tipo L en los miocitos cardíacos también causa remodelación cardíaca. En condiciones normales del cuerpo, los ácidos grasos representan del 60 al 90% del suministro de energía del corazón. Post IM, a medida que disminuye la oxidación de ácidos grasos, conduce a la reducción del suministro de energía para los miocitos cardíacos, la acumulación de ácidos grasos a niveles tóxicos y la disfunción de las mitocondrias. Estas consecuencias también llevaron al aumento del estrés oxidativo en el corazón, causando la proliferación de fibroblastos, la activación de metaloproteinasas y la inducción de apoptosis, que se explicaría a continuación. Además, la respuesta inmune inflamatoria después del IM también contribuye a los cambios anteriores.
Además, el intersticio cardíaco que consistía en gran parte de fibras de colágeno Tipo I y Tipo III también participa en el remodelado cardíaco. El colágeno cardíaco es sintetizado por fibroblastos y degradado por metaloproteinasas. Los fibroblastos se activan después del IM, lo que aumenta la síntesis de colágeno y la fibrosis del corazón. El aumento de la expresión de MMP1 y MMP9 condujo a la degradación de las fibras de colágeno y, posteriormente, a la dilatación del corazón. Se sabe que varias vías de señal, como la Angiotensina II, el factor de crecimiento transformador beta (TGF-beta) y la endotelina 1, desencadenan la síntesis y degradación de las fibras de colágeno en el corazón.
Otros factores como la presión arterial alta, la activación del sistema simpático que libera norepinefrina, la activación del sistema renina–angiotensina que libera renina y las hormonas antidiuréticas son contribuyentes importantes del remodelado cardíaco. Sin embargo, se cree que el péptido natriurético auricular es cardioprotector.