identifica a molécula mais ácida H
uma abordagem metódica funciona melhor. Simplificando, você deve escanear a molécula para grupos funcionais ácidos, e então classificar a reatividade desses grupos. O grupo funcional mais ácido geralmente é o mais ácido h em toda a molécula.
“Scan and rank” soa simples, mas esconde várias dificuldades que são elaboradas abaixo.
Scan uma molécula para grupos funcionais ácidos conhecidos
protões ácidos estão geralmente ligados a O ou N. Portanto, o primeiro passo é procurar todas as ligações OH e NH.
no entanto, à medida que você localizar ligações OH e NH, você vai precisar decidir se esses átomos ligados devem ser misturados em um grupo funcional com átomos vizinhos.
O único método conveniente para identificar um grupo funcional é já conhecer alguns. Por exemplo, se você sabe que ROH, RCO2H, e RSO3H são grupos funcionais ácidos comuns, você não terá dificuldade em encontrar grupos ácidos na molécula seguinte (os grupos corretos estão marcados em vermelho).
Rank OH e NH acidez separadamente
os valores pKa dos ácidos comuns OH e NH abrangem grandes gamas e as suas gamas sobrepõem-se. Ranking prossegue mais rapidamente se você classificar os ácidos OH e NH separadamente, e em seguida, comparar os melhores candidatos em cada categoria.
O método mais conveniente para classificar grupos ácidos é já conhecer os seus valores característicos de pKa. Se você conhece estes valores para todos os grupos ácidos de sua molécula, então o grupo com o menor pKa contém o mais ácido H. caso fechado.se não se lembrar dos valores de pKa para todos os grupos ácidos, alguns princípios gerais podem guiá-lo.
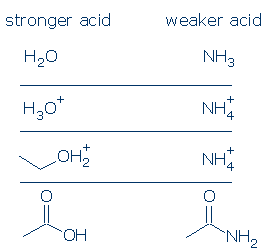
#1 importância-ácidos positivamente carregados são mais fortes do que ácidos neutros. Ácidos carregados negativamente raramente são ácidos. Se você comparar os valores de PKA dos ácidos OH comuns, você verá que os ácidos ROH2+ (que inclui H3O+ e R2OH+) são consideravelmente mais fortes do que os ácidos neutros, tais como RCO2H, PhOH, e ROH. Os únicos ácidos neutros que são mais fortes do que ROH2+ são H2SO4 e alguns outros RSO3H.
a regra de carga formal aplica-se ainda mais fortemente aos ácidos NH. A diferença em pKa entre H3O+ e H2O é de 18 unidades, enquanto que a diferença em pKa entre NH4+ e NH3 é de 26 unidades gigantescas.
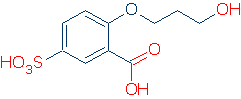
#2 Importância – olhar para a ativação de grupos, incluindo RSO2, RC=O, e Ph. O gráfico a seguir mostra como cada grupo de átomos ativa OH ácido (pKa valores variam de 16 a -2):
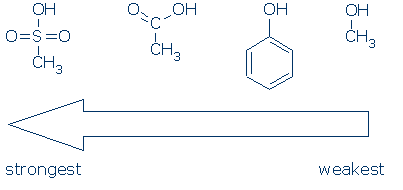
CH3 é considerado um espectador grupo sempre que aparece nestas moléculas. É não-Solar e não exerce um efeito indutivo de campo significativo, e é incapaz de deslocalizar carga. Consequentemente, é possível substituir o CH3 por outros grupos espectadores (por exemplo, H e outros R) sem afetar muito a reatividade.devem ser apresentados dois pontos adicionais relativos aos grupos de activação.
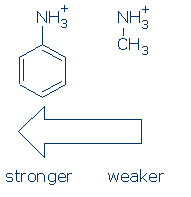
primeiro, os grupos exercem um efeito semelhante sobre os ácidos NH (e a sequência de ativação é a mesma: RSO2 > RC=o > Ph). Como acontece, você só precisa aprender o efeito de Ph em NH+ para este curso:
Em segundo lugar, os grupos activadores devem ser ligados directamente ao grupo OH (ou NH) para o activar. Os seguintes compostos têm valores de pKa similares porque os grupos ativadores não são ligados diretamente a OH: CH3C(=o)CH2OH, PhCH2OH, e CH3CH2OH.
#3 importância-todas as coisas sendo iguais, um ácido OH é mais ácido do que um ácido NH. Este princípio pode ser muito útil se for utilizado correctamente. Minha preocupação é que você entenda o que significa “todas as coisas sendo iguais. Isto significa que O E N devem ter a mesma carga formal (item #1) e devem ser ligados ao mesmo grupo ativador (item #2). No entanto, as diferenças nos grupos de espectadores não importam.
Algumas comparações válidas incluem:
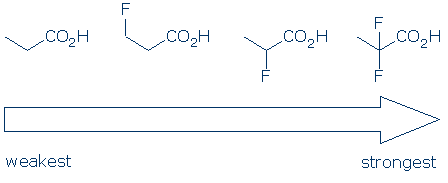
#4 Importância dentro de um grupo funcional categoria, use o substituinte efeitos para comparar ácidos. Substituintes eletronegativos geralmente aumentam a acidez de um grupo funcional através de uma combinação de efeitos de campo e indutivo. Estes efeitos são melhorados quando 1) o substituinte está localizado mais perto do grupo ácido, e 2) existem múltiplos substituintes. Dados estes princípios, esperamos que a acidez destes ácidos carboxílicos siga esta tendência: