Dipoles
para compreender a natureza das interações não-covalentes, primeiro devemos retornar às ligações covalentes e mergulhar no assunto dos dipolos. Muitas das ligações covalentes que temos visto –entre dois carbonos, por exemplo, ou entre um carbono e um hidrogênio-envolvem a partilha aproximadamente igual de elétrons entre os dois átomos na ligação. Nestes exemplos, os dois átomos têm aproximadamente a mesma eletronegatividade. Lembre-se de seu curso geral de química que a eletronegatividade se refere ao “poder de um átomo em uma molécula para atrair elétrons para si” (esta é a definição oferecida por Linus Pauling, o eminente químico americano do século XX, que foi o principal responsável pelo desenvolvimento de muitos dos conceitos de ligação que temos aprendido).
no Entanto, muitas vezes em química orgânica lidamos com ligações covalentes entre dois átomos com diferentes electronegativities, e, nesses casos, o compartilhamento de elétrons não é igual: o mais eletronegativos núcleo puxa os dois elétrons mais próximos. Na ligação carbono-oxigênio de um álcool, por exemplo, os dois elétrons na ligação sigma são mantidos mais perto do oxigênio do que eles são para o carbono, porque o oxigênio é significativamente mais eletronegativo do que o carbono. O mesmo é verdade para a ligação oxigênio-hidrogênio, como o hidrogênio é ligeiramente menos eletronegativo do que o carbono, e muito menos eletronegativo do que o oxigênio.
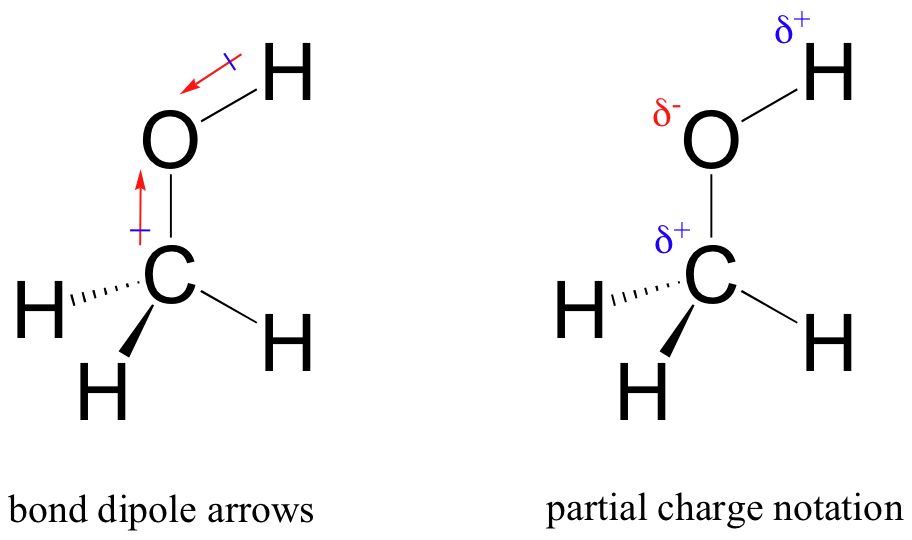
o resultado desta partilha desigual é o que chamamos de dipolo de ligação, que existe numa ligação covalente polar. Um dipolo de ligação tem extremidades negativas e positivas, ou polos, onde a densidade de elétrons é menor (o polo positivo) e maior (o polo negativo). A diferença na densidade de elétrons pode ser expressa usando a letra grega delta para denotar “parcial positivo” e “parcial negativo” carga sobre os átomos. “Setas dipoles”, com um sinal positivo na cauda, também são usadas para indicar a direção negativa (maior densidade de elétrons) do dipolo.
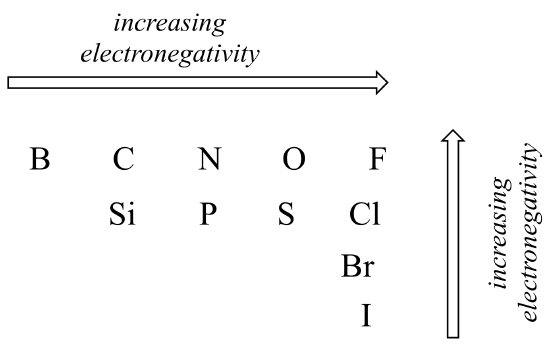
o grau de polaridade numa ligação covalente depende da diferença na eletronegatividade entre os dois átomos. A eletronegatividade é uma tendência periódica: ela aumenta indo da esquerda para a direita através de uma linha da tabela periódica dos elementos, e também aumenta à medida que subimos uma coluna. Portanto, o oxigênio é mais eletronegativo do que o nitrogênio, que por sua vez é mais eletronegativo do que o carbono. O oxigênio também é mais eletronegativo do que o enxofre. O flúor, no canto superior direito da tabela periódica, é o mais eletronegativo dos elementos. O hidrogênio é ligeiramente menos eletronegativo que o carbono.
Periódicas tendências em electronegativity
Exercício 2.26
Usando o que você sobre orbitais atómicas, racionalizar o periódico tendências em electronegativity. Por que aumenta da esquerda para a direita, e diminui de cima para baixo? Esta é uma boa pergunta para falar com colegas de classe e um instrutor ou tutor.
soluções para exercícios
a maioria das moléculas contém ligações covalentes polares e não-polares. Dependendo da localização das ligações polares e da geometria de ligação, as moléculas podem possuir uma polaridade líquida, chamada um momento dipolar molecular. A água, como provavelmente se lembram, tem um momento dipolar que resulta dos dipolos combinados das suas duas ligações oxigénio-hidrogénio. O fluorometano também tem um momento de dipolo.
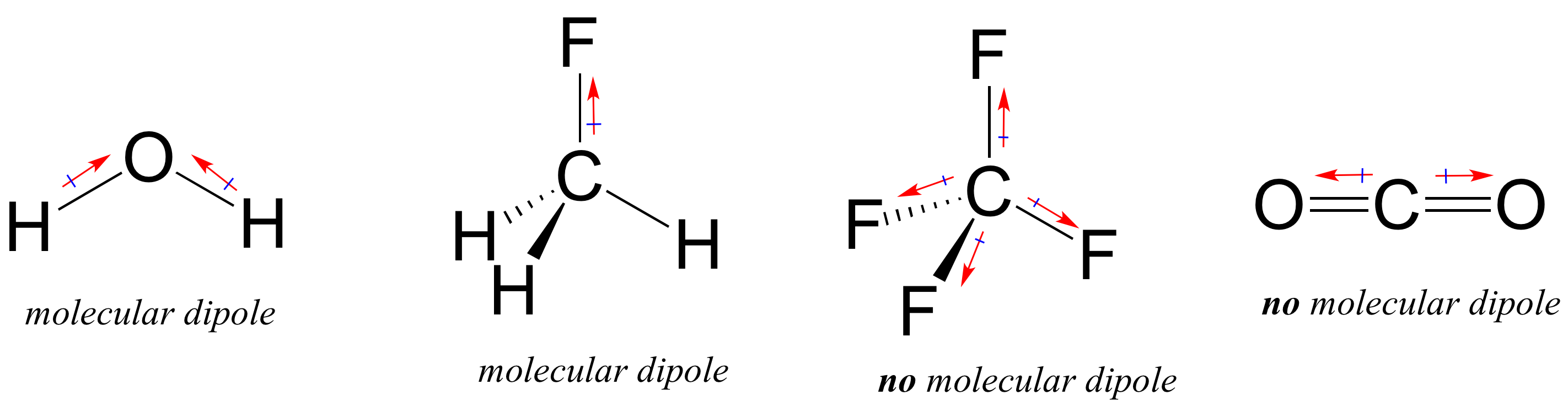
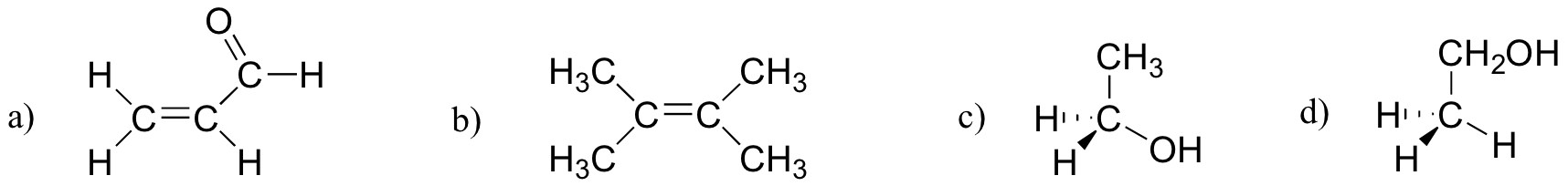
Tetrafluoromethane, no entanto, tem quatro ligações polares que puxar igualmente nos quatro cantos de uma tetahedron, o que significa que, embora existam quatro bond dipolos não existe molecular momento dipolar. O dióxido de carbono também carece de um momento dipolar molecular.Qual das moléculas abaixo tem momentos de dipolo molecular?
soluções para exercícios