VIVO Fisiopatologia
Outros Tópicos
Aquaporinas: Canais de Água
a Água atravessa as membranas celulares por duas vias: por difusão através da bicamada lipídica e através de canais de água chamado de aquaporinas. Caracterização funcional do primeiro aquaporina foi relatado em 1992, mas de canais de água eram suspeitos de existir bem antes que o tempo, porque a permeabilidade osmótica de alguns tipos de células epiteliais era muito grande para ser explicada por simples difusão através da membrana plasmática.um único canal aquaporin – 1 humano facilita o transporte de água a uma taxa de aproximadamente 3 bilhões de moléculas de água por segundo. Este transporte parece ser bidirecional, de acordo com o gradiente osmótico prevalecente.as aquaporinas clássicas transportam água livre de soluto através das membranas celulares; parecem ser canais de água exclusivos e não permeiam membranas para íons ou outras moléculas pequenas. Algumas aquaporinas-conhecidas como aquaglyceroporinas – transportam água mais glicerol e algumas outras moléculas pequenas.
a família Aquaporin
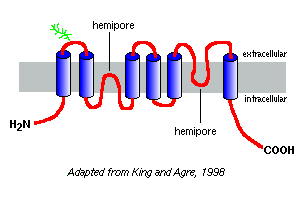
Mais de 10 aquaporinas diferentes de mamíferos foram identificadas até à data, e suspeita-se que existam membros adicionais. Proteínas estreitamente relacionadas com os canais de água têm sido isoladas de plantas, insetos e bactérias. Aquaporin-1 dos glóbulos vermelhos humanos foi o primeiro a ser descoberto e é provavelmente o melhor estudado.as parcelas de hidrofobicidade das suas sequências de aminoácidos prevêem que as aquaporinas têm seis segmentos de membrana, tal como representado no modelo de aquaporina-1 à direita.com base em estudos com aquaporina-1, parece que as aquaporinas existem na membrana plasmática como homotetramers. Cada monômero de aquaporina contém dois poros hemi, que se dobram juntos para formar um canal de água.as diferentes aquaporinas têm diferentes padrões de glicosilação. No caso da aquaporina-1, a espinha dorsal do péptido é de aproximadamente 28 kDa e as formas glicosiladas variam de 40 a 60 kDa em massa. A maioria das aquaporinas tem uma proteína cinase um motivo de fosforilação em um dos loops citoplásmicos, e fosforilação diferencial é suspeita empartar uma função regulatória para a molécula.cada um dos aquaporinos tem um padrão de expressão essencialmente único entre os tecidos e durante o desenvolvimento. Um resumo desses atributos e de algumas importantes potenciais ou conhecidos funções é apresentada na tabela a seguir:
| Principais Sites de Expressão | ||
|---|---|---|
| Aquaporina-0 | Olhos: lente de fibra de células | equilíbrio de Fluidos no interior da lente |
| Aquaporina-1 | células Vermelhas do sangue | Osmótica de proteção |
| Renal: proximal tubule | Concentration of urine | Eye: ciliary epithelium | Production of aqueous humor | Brain: choriod plexus | Production of cerebrospinal fluid | Lung: alveolar epithelial cells | Alveolar hydration state |
| Aquaporin-2 | Kidney: collecting ducts | Mediates antidiuretic hormone activity |
| Aquaporin-3 * | Kidney: collecting ducts | Reabsorbtion of water into blood |
| Trachea: células epiteliais | Secreção de água na traquéia | |
| Aquaporina-4 | Renal: a coleta de condutas | Reabsorbtion de água |
| Cérebro: ependymal células | QCA equilíbrio de fluidos | |
| Cérebro: o hipotálamo | Osmosensing função? | |
| Lung: brônquica epitélio | Brônquica fluido secreção | |
| Aquaporina-5 | glândulas Salivares | Produção de saliva |
| glândulas Lacrimais | Produção de lágrimas | |
| Aquaporina-6 | Renal | Muito baixa permeabilidade à água; função? |
| Aquaporina-7 * | células de Gordura | Transportes de glicerol de adipócitos |
| Testículo e do esperma | ||
| Aquaporina-8 | Testículo, pâncreas, fígado, outros | |
| Aquaporina-9 * | Leucócitos | |
| * um aquaglyceroporin | ||
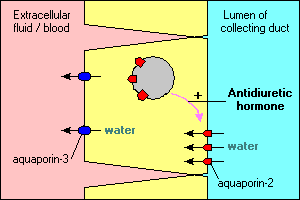
Deve estar claro que aquaporinas são amplamente distribuídos, e também que os diferentes aquaporinas têm diferentes funcionalmente importantes especialidades.várias características interessantes e importantes do transporte de água mediado pela aquaporina são ilustradas nas células principais que lineiam os canais colectores no rim. A água que flui através destas condutas pode Continuar e ser expelida na urina ou ser reabsorvida através do epitélio e de volta para o sangue. A reabsorção é essencialmente nula, a menos que as células epiteliais vejam a hormona antidiurética, que estimula fortemente a reabsorção da água. As células colectoras expressam pelo menos duas aquaporinas:
- Aquaporina-2 é sintetizada mas, no absenso da hormona antidiurética, reside num conjunto de vesículas de membrana no citoplasma. Ligação do hormônio antidiurético ao seu receptor na célula, não só estimula a transcrição da aquaporina-2 do gene, mas faz com que o pool intracelular de aquaporina-2 para ser inserido na membrana apical. A célula é agora capaz de absorver eficientemente água do lúmen do ducto.a Aquaporina-3 é constitucionalmente expressa na membrana basolateral da célula. Quando a água inunda na célula através dos canais aquaporin-2, Ela pode sair rapidamente da célula através dos canais aquaporin-3 e fluir para o sangue.
Aquaporinas e Doença
Considerando a importância do transporte de água em uma infinidade de processos fisiológicos, espera-se que lesões no aquaporina genes ou adquirida disfunção aquaporinas, podem causar ou contribuir para vários estados de doença. A busca por tais conexões ainda é precoce, mas dois exemplos claros de doença foram identificados como resultantes de deficiência em aquaporinas:mutações no gene aquaporin-2 causam diabetes insípida nefrogénica hereditária no ser humano.ratinhos homozigóticos para inactivar mutações no gene da aquaporina-0 desenvolvem Cataratas congénitas.a obesidade de início adulto desenvolve-se em ratinhos homozigóticos para inactivar mutações no gene aquaporin-7, presumivelmente devido à ineficiência no transporte de glicerol a partir de triglicéridos hidrolisados.um pequeno número de pessoas foi identificado com deficiência grave ou total em aquaporin-1. Curiosamente, eles parecem clinicamente não afetados, mas não foram examinados em condições de privação de água. Ratos com deleções direcionadas em aquaporin – 1 também parecem normais e saudáveis, a menos que sejam fluidos restritos, caso em que se tornam severamente hiperosmolares.
References and Reviews
- Borgnia M, Nielsen S, Engel a, Agro P: Cellular and molecular biology of aquaporin water channels. Annu Rev Biochem 68: 425, 1999.deGroot BL, Grubmuller H: permeação de água através das membranas biológicas: mecanismo e dinâmica da aquaporina-1 e GlpF. Ciência 294:2353, 2001.
- Hibuse T, Proc Nat Acad Sci (USA) 102:10993, 2005.King LS, Agre P: Pathophysiology of the aquaporin water channels. Annu Rev Physiol 58: 619, 1998.Knepper MA, Inoue T: Regulation of aquaporin-2 water channel trafficking by vasopressin. Curr Opinion Cell Biol 9: 560, 1997.Lee MD, King LS, Agre P: The aquaporin family of water channel proteins in clinical medicine. Medicine 76: 141, 1997.Preston GM, Carroll TP, Guggino WP Agre P: Appearance of water channels in Xenopus oocytes expressing red cell CHIP28 protein. Science 256: 385, 1992.Sasaki S, Ishibashi K, Marumo F: Aquaporin – 2 e -3: representantes de dois subgrupos da família aquaporin colocalizados no ducto de coleta de rins. Annu Rev Physiol 60: 199, 1998.