Biomateriais
é possível delimitam o estudo de biomateriais através de uma forma muito geral, mas coerente definição pelo Parque e Lagos . De acordo com eles, um biomaterial pode ser definido como qualquer material utilizado no fabrico de dispositivos para substituir parte ou função do corpo de uma forma segura, confiável, econômica e fisiologicamente aceitável.
a fim de desempenhar satisfatoriamente a função de substituir, ampliar ou suportar uma estrutura, o implante deve imitar ou corresponder às características do tecido. A literatura relata a existência de diferentes tipos de enxertos ósseos utilizados em implantes: autólogo (derivado do mesmo indivíduo); homólogo do ano anterior (a partir de um indivíduo da mesma espécie do receptor); e heterologous (quando a espécie do doador e o destinatário não são o mesmo – o gado, por exemplo ).
os enxertos autólogos têm certas desvantagens, por exemplo: intervenção numa área saudável do corpo do doente; morbilidade na área do dador, maior período de recuperação; susceptibilidade a infecções; e reabsorção progressiva e constante . Assim, os implantes em biomateriais sintéticos, como cerâmica e polímeros, têm sido amplamente desenvolvidos e aplicados. De acordo com Pereira, Buono e Zavaglia , a demanda por biomateriais cresceu de 5 para 15% todos os anos.
Classificação dos biomateriais
de Acordo com Banheira e Santos , os biomateriais podem ser classificados em quatro classes, de acordo com a compatibilidade com os tecidos circundantes:
Biotolerant: Implante separado do osso adjacente por uma camada de tecido mole sobre a interface. Não há contacto NA osteogénese. A camada é induzida pela liberação do implante de monômeros, íons e/ou produtos de corrosão. Quase todos os polímeros sintéticos e a maioria dos metais São esta categoria.
Bioinert: Implantes em contacto directo com o tecido ósseo, envolvimento na osteogénese. No entanto, não há reação química entre o tecido e o implante. Não existe, pelo menos em quantidades detectáveis pelas células, a libertação de qualquer componente. Exemplos de biomateriais bioinertais são: alumina, zircônia, titânio, tântalo, nióbio e carbono.
Bioactive: existe a interacção entre o implante e o tecido ósseo, interferindo directamente na osteogénese. Por semelhança química, a parte mineral do tecido ósseo liga-se ao implante, promovendo a osteocondução. Os principais materiais desta classe são: Ca-fosfato, in vitro-cerâmica e hidroxiapatita.
Bioresorbable: materiais que, após um determinado período de tempo em contacto com os tecidos, acabam por ser degradados, solubilizados ou fagocitados pelo organismo. São de interesse em aplicações clínicas em que não é aconselhável reabrir o implante. São representativos desta classe o fosfato tricálcico (TCP) e a PLLA (ácido poli-L-láctico).
Metalizado biomateriais
às Vezes, elementos metálicos em suas formas naturais e em pequenas quantidades, são tolerados pelo organismo, como o ferro (Fe) das células vermelhas do sangue, cobalto (Co) na síntese de vitamina B12 , e no cross-links da elastina presentes na artéria aorta . No entanto, em grandes quantidades, a maioria dos metais não são tolerados pelo corpo.
alguns metais são utilizados como substitutos de tecidos duros, por exemplo, em próteses totais da anca e do joelho, placas e parafusos para fixação de fracturas, dispositivos de fixação de colunas e implantes dentários devido às suas excelentes propriedades mecânicas e resistência à corrosão . De acordo com Barbucci , um metal material utilizado na construção do ortopédicos, próteses, dispositivos de osteossíntese, e implantes dentários deve ter as seguintes características:
- Limite de resistência igual ou superior a 800 MPa;
- Resistência à corrosão (local e geral);biocompatibilidade.
biocompatibilidade não é um efeito ou um fenômeno único. Refere-se a uma série de processos envolvendo diferentes mecanismos de interação, mas interdependentes no que diz respeito a materiais e tecidos. É a capacidade do material para desempenhar uma função específica no organismo sem causar efeitos tóxicos ou prejudiciais nos sistemas biológicos .
estas características são tão restritivas que apenas um pequeno número de classes de materiais metálicos pode ser usado com sucesso.
a primeira liga especificamente desenvolvida para o uso no corpo humano foi o “aço vanádio”, usado para o fabrico de placas e parafusos para fraturas ósseas . Entre os biomateriais metálicos, aço inoxidável austenítico do tipo 316 LVM, ligas Co-Cr-Mo, Co-Ni-Cr-Mo, titânio puro e Ti-6Al-4V são os mais utilizados . Alguns exemplos são mostrados na Figura 1.

Figura 1: dispositivos Metálicos de aplicação médica: a) a cabeça Femoral; b) superior a articulação do joelho; c) placa da articulação Mandibular.
neste trabalho, vamos abordar mais especificamente ligas Co e Ti, cuja aplicação em DMLS prototipagem rápida no campo médico é mais expressiva.ligas de cobalto foram originalmente propostas para implantes cirúrgicos há mais de 70 anos . Existem basicamente dois tipos de ligas de Co para aplicação médica. A liga Co-Cr-Mo para revestimento e as ligas trabalhadas Co-Ni-Cr-Mo . A Sociedade Americana para Testes e Materiais (ASTM) lista quatro Co ligas que são recomendados para uso em implantes cirúrgicos: revestimento de liga de Co-Cr-Mo (F75) e trabalhou ligas de Co-Cr-W-Ni (F90), Co-Ni-Cr-Mo (F562), e Co-Cr-Mo (F1537).
Estas ligas são uma classe de materiais altamente resistentes à corrosão em ambientes fisiológicos e ao desgaste, realização de aço inoxidável . Além disso, o seu limite superior de resistência à fadiga e a resistência à fadiga permitem a sua aplicação nos casos em que é necessária uma longa vida útil sem a ocorrência de fracturas ou de tensões/fadiga . Muitas propriedades são originadas da natureza cristalográfica do cobalto, o efeito impulsionador de Cr e Mo, e a formação de carbonetos de alta dureza .
tais características especiais levaram ao uso dessas ligas em várias aplicações médicas, particularmente nas que visam substituir as superfícies articulares. Suas propriedades de resistência ao desgaste, corrosão e baixo coeficiente de atrito são decisivas nesta escolha.
um exemplo de aplicação é a artroplastia total da anca (THA). Os sistemas mais recentes consistem em uma haste femoral ligada a uma cabeça modular sujeita a coordenação com o componente acetabular . Este sistema é conhecido como MoM (metal em metal) – em referência à superfície de contato-e é melhor do que MoP (metal em polietileno) sistemas, utilizados em relação à taxa volumétrica de desgaste e outros parâmetros até agora, como relatado em . A figura 2 mostra um exemplo dos sistemas MOP e MoM para o THA.

Figura 2: à esquerda: MoP; à direita: a Mãe.
outro exemplo de aplicação de ligas Co, ao qual este trabalho está diretamente relacionado, é a reconstrução total da articulação temporomandibular. Este tipo de prótese, conhecida como prótese Christensen, está em uso há mais de 30 anos e é caracterizada pela promoção de uma reconstrução estável, confiável e previsível, proporcionando a redução do nível de dor, melhoria na funcionalidade e maior grau de movimento . A figura 3 ilustra uma prótese temporomandibular.
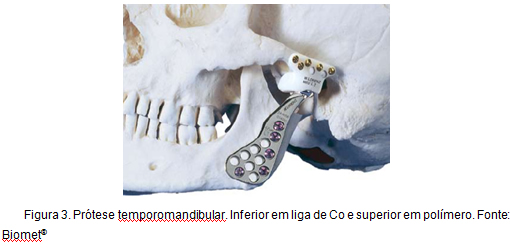
Figura 3: Disfunção da prótese.
ligas de Titânio
Descoberto em 1791 por William Gregor, uma Britânica de mineralogista , titânio e, mais recentemente, das suas ligas – tem sido utilizada há décadas na fixação de fraturas articulares e reconstrução como cumprir os requisitos necessários para aplicações biomédicas, tais como: resistência ao desgaste, biocompatibilidade, bioadesão (indução do crescimento ósseo), módulo de elasticidade (quanto mais próximo do osso humano – 10-30 GPa -, melhor), resistência à fadiga e boa processabilidade,
titânio tem uma estrutura hexagonal fechada packed (hcp) relacionada à fase alfa, que pode sofrer uma mudança alotrópica a 88º C para a estrutura cúbica centrada no corpo (bcc) conhecida como a fase beta. A manipulação destas características cristalográficas pela adição de ligantes e processos Termomecânicos permite a obtenção de ligas com várias propriedades.
titânio classes que foram inicialmente introduzido como biomateriais foram ASTM F67 (titânio comercialmente puro em graus 1, 2, 3 e 4), ASTM F136 (liga Ti-6Al-4V Extra Baixa Intersticial) e ASTM F1472 (liga Ti-6Al 4W-padrão) . Nestes materiais, alguns elementos de liga estabilizam a fase alfa enquanto outros estabilizam a fase beta. Pode-se estabilizar a fase alfa incluindo alumínio, estanho e zircônio, enquanto que a fase beta pode ser estabilizada com vanádio, molibdênio, nióbio, crómio, ferro e manganês . Note-se, portanto, que a liga ASTM F136 é um exemplo de liga alfa/beta estabilizada.
Parte da resistência ao desgaste observado em titânio e suas ligas é devido à formação de um passivo camada de óxido que consiste principalmente de TiO2 que adere à superfície do metal e o protege, além de ser o grande responsável para a biocompatibilidade do material. Esta camada pode ser obtida por oxidação anódica no eletrólito do ácido acético e, quando a presença de titânio no tecido adjacente ao implante é avaliada, é substancialmente menor no implante anodizado se comparado com aqueles sem anodização da superfície,
trauma Grave na estrutura facial requer um grande número de placas e parafusos, e os implantes de titânio são particularmente adequados, por causa das propriedades citadas nesta revisão. Há placas e parafusos para a região cranio-maxilofacial em várias configurações para que o médico possa ajustar o sistema à anatomia do paciente. A figura 4 é um exemplo de aplicação do titânio na fixação das fraturas cranio-maxilofacial.

Figura 4: Placas para fixação de cranio-maxilo-facial fraturas.
outra aplicação que demonstra a versatilidade do material ocorre nas varetas intramedulares para fractura fechada da tíbia e composta , onde o implante (Figura 5) é indicado para fracturas ósseas maiores e submetido a maiores tensões mecânicas (tíbia).
Figura 5: veio intramedular Tibial em Ti.
Cerâmica Biomateriais
O desenvolvimento de materiais cerâmicos para aplicações biomédicas concentra-se principalmente nas áreas de ortopedia e odontologia . É uma classe de materiais que inclui várias características de biomateriais. Tem representantes das classes bio-inertes, bioresorbíveis, bioativas e porosas para o crescimento de tecidos .
O potencial de cerâmica como biomateriais vem de sua semelhança com o ambiente fisiológico, devido à sua constituição de base de íons que são também encontradas em ambiente fisiológico (cálcio, potássio, magnésio, sódio, etc.) e outros cuja toxicidade é muito limitada (zircónio e titânio) .
as cerâmicas bio-inertes são mais representativas nos compostos de alumina (Al2O3), zircônia (ZrO2), e zircônia estabilizada com óxido de ítrio (ZrO2 (Y2O3)). Sua capacidade de não reagir com o tecido circundante, resistência à corrosão, alta resistência ao desgaste e alta resistência mecânica são características essenciais em seu uso como superfícies articulantes sujeitas a cargas e atrito .
No coração de bioativos e bioresorbable cerâmica, pode-se encontrar compostos tais como a hidroxiapatita (HA), fosfatos de cálcio, especialmente, a β-fosfato tricálcico (β-TCP), bem como a bioglasses de vidro e de cerâmica, cuja composição é composta de uma grande variedade de óxidos (SiO2, P2O5, CaO, CaF2, Na2O, Al2O3, Ta2O5, e TiO2, entre outros.) .
Park, J; Lakes, R. S. “Biomaterials – An Introduction”. Springer. 3ª edição. 2007. p. 2.
Gália, C. A; et al. “Uso de enxerto homólogo e heterólogo em diáfise femoral de ratos: comparação entre enxerto ósseo congelado e liofilizado”. Revista Brasileira de Ortopedia e Traumatologia. Março 2005.
Marzola, C; Toledo Filho, J. L. “Fundamentos de Cirurgia Buco Maxilo Facial – Os implantes de materiais aloplásticos”. Capitulo X.
Pereira, M. M; Buono, V. T. L; Zavaglia, C. A. C. “Materiais metálicos: ciência e aplicação como biomateriais. In: Oréfice, R. A; Pereira, M. M; Mansur, H. S. “Biomateriais: fundamentos e aplicações”. Rio de Janeiro. Cultura Médica, 2006, cap. 2, p. 39-58.
Bath, S. V. “Biomaterials”. Narosa Publishing House. Nova Dheli, Índia. 2002. p. 181
Santos, L. A. “Desenvolvimento de fosfato de cálcio reforçado por fibras para uso na área médico-odontológica.”Tese de Doutorado. Universidade Estadual de Campinas. 2002.
Wong, J. Y; Bronzinho, J. D. “Biomaterials”. Taylor e Francis Group. LLC. 2007. p. 1-1.
Barbucci, R. “Integrated Biomateriais Science”. Kluwer Academic / Plenum Publishers. Nova Iorque.2002. Cap. 6. p. 289-290.
Bertol, L. S. “Contribuição ao estudo da prototipagem rápida, digitalização tridimensional e seleção de materiais no design de implantes personalizados”. Dissertação de Mestrado. Universidade Federal do Rio Grande do Sul. Porto Alegre. 2008.
Donachie M. “Metals Handbook Desk Edition”. 2ª edição, editada por Davis, J. R. ASM International. 1998.
Disegi, J. A; Kennedy, R. L; Pilliar, R. “Cobalt-Base Alloys for Biomedical Application”. ASTM – STP 1365. 1999.
Shi, D. “Introduction to Biomaterials”. Tsinghua University Press, World Scientific. 2006. p – 123.Marti, A. “ligas à base de cobalto utilizadas em cirurgia óssea”. Lesão-International Journal of the care of the Injured. 2000 (31).
Wnek, G. e; Bowlin, G. L. “Encyclopedia of Biomaterials and Biomedical Engineering”. Vol 2. 2ª edição. Informa Healthcare. 2008.
Sieber, H. P; Rieker, C. B; Köttig, P. “Analysis of 118 second-generation metal-on-metal retrieved hip implants”. The Journal of Bone & Joint Surgery (Br). 1998; 80-B: 46-50.Garret, W. R; Abbey, P. A; Christensen, R. “Temporomandibular joint reconstruction with a custom total temporomandibular joint prothesis: Use in the multiply operated patient”. A reprint from Surgical Technology International VI.
Leyens, C; Manfred, P. “Titanium and Titanium alloys: fundamentals and applications”. Wiley-VCH. Primeira edição. 2003. p-1.Yaszemski, M. J; Tantrolo, D. J; Lewandrowski, K; Hasirci, V; Altobelli, D. E.; Wise, D. L. “Biomaterials in Ortopedia”. Marcel Dekker Inc. 2004. p-2.Lütjering, G; Williams, J. C. ” Titanium – Engineering Materials and Processes. Springer-Verlag. Second edition. 2003. p-399.
Brown, S. A; Lemons, J. E. “Medical applications of titanium and its alloys: the material and biological issues”. Proceedings of a symposium held in 1994 in Phoenix, Arizona. STP 1272. ASTM. 1996.
Morena, D. M; Tengvall, P; Textor, m; Thomsen, P. “Titanium in medicine: material science, surface science, engineering, biological responses and medical applications”. Springer-Verlag. 2001. p-28.Larsson, C; Thomsen, P; Aronsson, B. O; Rodahl, M; Lausmaa, J; Kasemo, B; Ericson, L. E. “Bone response to surface-modified titanium implants: studies on the early tissue response to machined and electropolished implants with different oxide thicknesses”. Biomaterias 17 (1996) 605-616. Elsevier .Jorgenson D. S; Centeno, J. A; Mayer M. H; Topper, M. J; Nossov, P. c; Mullick, F. G; Manson, P. N. “Biologic response to passive dissolution of titanian craniofacial microplates”. Biomaterials 20 (1999) 675-682. Elsevier.Zimmer Sirus® – sistema intramedular de unhas. Zimmer, 2007.
Shakelford, J. F. “Bioceramics-Advanced ceramics; v. 1”. Gordon and Breach Science Publishers, 1999. p-5.
Hench, L. L. “Bioceramics: From concept to Clinic”. J. Am. Ceram. Soc., 74 (7) 1487-510 (1991).
Hench, L. L; Wilson, J. “An introduction to Bioceramics”. World Scientific Publishing Co, 1993. p-25.Bubok, V. A. “biocerâmica-Ontem, Hoje, Amanhã”. Metalurgia dos pós e cerâmica metálica, Vol. 39, No. 7-8, 2000.
Personalizável próteses
Cranio-maxilo-facial reconstrução através de prototipagem rápida
prototipagem Rápida é uma técnica de fabricação de peças pelo método aditivo. Um modelo 3D criado em um sistema CAD é seccionado em perfis 2D que são então construídos por equipamentos de prototipagem rápida camada por camada. Várias técnicas estão disponíveis hoje, tais como: estereolitografia (SLA), sinterização de Laser De Metal direto (DMLS), superfície de Laser derretida (LSM), Modelagem de deposição fundida (FDM), Impressão 3D (3DP) e soldagem de feixe de elétrons (EBW) .
Na primeira década do uso da LMG técnica, de 1994 a 2004, foi dominada, pelo menos nas suas aplicações comerciais, por materiais desenvolvidos especificamente para o LMG processo, ou seja, com foco em melhorias na processabilidade e propriedades aceitáveis para as aplicações mais comuns. Atualmente, uma ampla gama de ligas está disponível para uso em DMLS, como ligas leves de titânio. De especial interesse na área médica são o Ti-6Al-4V-titânio, alumínio, vanádio e Ticp – titânio comercialmente puro. Ambos são caracterizados por suas excelentes propriedades mecânicas, resistência à corrosão, baixo peso específico, e especialmente por sua biocompatibilidade .
tradicionalmente, prototipagem rápida (RP) é usada na indústria e engenharia como um meio para produzir protótipos confiáveis em um curto período de tempo, o que traz ganhos No custo . Recentemente, a RP alargou a sua aplicação para além dos produtos de engenharia. Seu uso no campo médico para a fabricação de implantes e próteses personalizados, o estudo de anatomia e planejamento cirúrgico incluem importantes áreas de pesquisa . O apelo sobre o campo médico ocorre enfrentando obstáculos significativos, como o fato de que um caso nunca é igual um ao outro – razão pela qual a padronização na produção de implantes não é vantajosa – e as questões relativas aos pontos obscuros da região da cirurgia dificultam o planejamento cirúrgico .
Entre os defeitos congênitos, anomalias craniofaciais (CFA) são um grupo altamente diverso e complexo que afeta uma proporção significativa de pessoas no mundo .
além dos casos de deformidades congênitas, existem defeitos craniofaciais adquiridos devido a outras doenças – tumores, por exemplo. Nas últimas quatro décadas, observou-se também um volume crescente de casos de trauma facial, que está intimamente ligado ao aumento dos acidentes de viação e da violência urbana.
em todos os casos, a reabilitação cranio-maxilofacial faz parte do processo de reintegração dos pacientes na sociedade e a promoção do bem-estar.
prototipagem Rápida no crânio e face reconstrução
Os meios convencionais de fabricação de um implante para reparo do defeito craniano consiste na modelagem direta do implante no sítio cirúrgico, durante a cirurgia. A impressão é feita em cera e posteriormente utilizada na fabricação de um molde biomaterial . No final da década de 1980, apareceram os resultados da primeira pesquisa que tentou encontrar uma maneira de produzir um modelo físico diretamente a partir de um modelo tridimensional digital .
Prototipagem Rápida é um método de fabricação, camada por camada, que pode produzir geometria complexa a partir de um modelo CAD .
seu uso em aplicações médicas revolucionou o planejamento de cirurgias complexas através da construção de modelos anatômicos pré-operatórios que permitem que o pessoal médico tenha uma avaliação crítica de cada caso particular . Ele também recebeu grande ênfase em seu uso na fabricação personalizada de implantes para a reconstrução do crânio e falhas faciais , , , , .
na construção de implantes personalizados, a entrada dos dados dos pacientes é necessária. Os dados são obtidos a partir de CT ou NMRI em fatias transversais 2D em formato DICOM, cuja espessura é determinada no equipamento ao obter as imagens. O número de fatias é o que determina a resolução da imagem e, portanto, o modelo 3D. As fatias 2D são transferidas para o software de modelagem médica onde é possível ajustar o sinal limiar a fim de obter, após interpolação, uma representação 3D da estrutura óssea .
após a obtenção do modelo, ele pode ser manuseado em software CAD para a modelagem do implante que irá reparar o defeito ósseo.
The patterned solid is then converted into the STL format and can be prototyped by any rapid prototyping techniques.
aplicações recentes, materiais e relatórios de casos
na área de reparação cranio-maxillofacial, vários casos de aplicação bem sucedida de tecnologias de modelagem 3D e prototipagem rápida para ter implantes personalizados foram relatados.
Bertol et al. relatou o uso de imagens de tomografia na obtenção de um modelo virtual em 3D para o virtual procedimento de ressecção de parte da mandíbula afetada por um tumor e posterior desenho de implante para substituir a região afetada pela técnica de espelhamento plano de simetria, onde a parte saudável da mandíbula é espelhado e utilizados na reconstrução do removidos da região.
Figura 7: processo de obtenção do modelo 3D e implante (à esquerda). Implante construído por DMLS (à direita) .
o implante foi construído em titânio (Ti-6Al-4V) usando a técnica de sinterização laser de Metal direto (DMLS). Neste processo, o metal em pó é fundido em uma parte sólida através do derretimento local fornecido por um feixe de laser de alta energia dirigida por computador de acordo com o projeto da peça.
após a fabricação do implante, ele foi digitalizado pela técnica de digitalização 3D para a comparação dimensional com o modelo virtual. As diferenças não eram maiores que 0,05 mm, o que demonstra a precisão do método.
Drstvensek et al também relataram casos de sucesso que demonstram o grande potencial de prototipagem rápida no campo médico. Em um caso relatado, uma grave assimetria facial (microssomia hemifacial) foi tratada. A metodologia utilizada foi semelhante à utilizada pela Bertol et al. Modelos 3D foram obtidos a partir de imagens CT e o implante foi desenvolvido em ambiente virtual, refletindo a parte não afetada.
Figura 8: modelo Virtual da área a ser construída (à esquerda); implante fabricado por DMLS .
In another case reported by Drstvensek et al , it was used the same techniques in the manufacturing of a skull implant and posterior 3D scanning for dimensional control. Em comparação com o modelo virtual, o implante mostrou variações de 0,8 a 1,0 mm em algumas regiões. Segundo o autor, devido ao fato de a região em questão não estar localizada em uma parte crítica, o implante foi aprovado e implementado com sucesso. A técnica de prototipagem utilizada em ambos os casos foi DMLS e o material foi Ti-6Al-4V.
Figura 9: Prótese fabricada por DMLS (à esquerda). Resultado da inspeção geométrica virtual (à direita).
recentemente, vários estudos têm focado na Associação de propriedades na fabricação de implantes. Isto ocorre, por exemplo, na combinação de propriedades de resistência mecânica e corrosão de titânio com a bioatividade de cerâmica como HA e α-TCP.
Ning e Zhou , avaliaram a bioactividade in vitro e in vivo de biocomposite fabricada a partir de pó de HA e Ti pelo método metalúrgico do pó. Misturas em várias proporções de HA/Ti foram misturados e sintetizados, a 1200° C. Os resultados mostram que os compósitos com maior o teor de Ti têm a capacidade de induzir a nucleação e o crescimento de apatite em sua superfície, que proporcionam o crescimento ósseo e fazer o metal/cerâmica biocomposites candidatos para o osso de substituição.
Kim et al depositaram películas densas e uniformes de HA e FHA (hidroxiapatita-fluoro) com espessura ~ 5 µm em substratos de titânio utilizando a técnica de sol-gel. O substrato apresentou crescimento favorável e proliferação de osteoblastos, aumentando a atividade e função do substrato.
ao longo da mesma linha de trabalho, Bertol relatou dois casos com a associação de Ti e α-TCP. Um implante personalizado foi obtido por moldagem manual no modelo físico do paciente obtido a partir de imagens tomográficas (chão orbital), enquanto o outro foi maquinado de acordo com o design virtual também obtido a partir de imagens tomográficas (mandíbula). Em ambos os casos, os implantes foram revestidos com α-TCP e implementados com sucesso.
Figura 10:
Não só o titânio, mas também o Co ligas têm vindo a utilizar cerâmica, compósitos, a fim de melhorar algumas de suas propriedades. Yen et al relatam o revestimento eletrolítico de uma liga Co-Cr-Mo com ZrO2 para uma prótese da anca. Neste caso, a aplicação do revestimento reduziu o desgaste do componente metálico contra o componente polimérico e reduziu o coeficiente de atrito entre as superfícies.
Khan, S. F.; Dalgarno K. W. “Design of customized Medical Implants by Layered Manufacturing”. Escola de Engenharia Mecânica e de Sistemas. NC University-UK.
Ma, D; Lin F; Chua C. K. “Rapid Prototyping Applications in Medicine. Part 1: NURBS-Based Volume Modelling”. The International Journal of Advanced Manufacturing Technology. Springer-Verlag London Limited. 2001
Lima, B. C. “Engenharia Reversa e Prototipagem Rápida: Estudo de Casos”. pp 15-16. 2003.
Shellabear, M; Nyrhilä, O. “DMLS-Development History and State of the Art”. LANE, Erlanger. 2004.Shellabear, M; Nyrhilä, O. “Advances in Materials and Properties of Direct Metal Laser-Syntered Parts”. LANE, Erlanger. 2004.
Molleó, I. L. “Anomalias Craniofaciais, Genética e Saúde Pública: contribuições para o reconhecimento da situação atual da assistência no Sistema Único de Saúde”. Unicamp. 2004.
Lima Silva, J. J. de; Lima, A. A. A. S.; Torres, S. M. “Fraturas de face: análise de 105 casos”. Revista Brasileira de Cirurgia Craniomaxilofacial / Associação Brasileira de Cirurgia Crânio-maxilo-facial. – Vol.12, n.1 (Jan.2009).
Gopakumar, S. “RP in medicine: a case study in cranial reconstructive surgery”. Rapid Prototyping Journal. Volume 10 · Number 3 · 2004 · pp. 207–211.
Bertol, L. S. “Contribuição ao estudo da prototipagem rápida, digitalização tridimensional e seleção de materiais no design de implantes personalizados”. Dissertação de Mestrado. Universidade Federal do Rio Grande do Sul. Porto Alegre. 2008.
Naber, H. “Advances in rapid prototyping technologies”, Materials and Manufacturing Conference, Metalex, Thailand. 1998.
Gibson, I; Cheung, L. K; Chow, S. P; Cheung, W. L; Beh, S. L; Savalani, m; Lee, S. H. “The use of rapid prototyping to assist medical applications”. Rapid Prototyping Journal 12/1 (2006) 53-58.
Hench, L. L. “Bioceramics: From concept to Clinic”. J. Am. Ceram. Soc., 74 (7) 1487-510 (1991).
Wu, W; Shang, Y; Li, H; Wang, W. “fabricação de reparação de defeitos ósseos no crânio com base na prototipagem rápida”. Journal of Bioactive and Compatible Polymers, Vol. 24-Maio 2009.
Bertol, L. S; Junior, W. K; Silva, F. P. d. ; Aumund-Kopp, C. “Medical design: Direct metal laser sintering de Ti-6Al-4V”. Materiais e Design (2010), doi: 10.1016/j. matdes.2010.02.050.Oliveira, R. S. D; Brigato, R; Madureira, J. F. G; Cruz, A. A. V; Filho, F. V. D. M.; Alonso, N; Machado, H. R. “Reconstruction of a large complex skull defect in a child: a case report and literature review”. Childs Nerv Syst (2007) 23:1097-1102.
Drstvensek, I; Hren, N. I; Strojnik, T; Brajlih, T; Valentan, B; Pogacar, V; Hartner, T. Z. “Aplicações da Prototipagem Rápida no Crânio-Maxilofacial Procedimentos de Cirurgia”. International Journal of Biology and Biomedical Engineering. Issue 1, volume 2, 2008.
Ning, C. Q; Zhou, Y. “in vitro bioactivity of a biocomposite fabricated from HA and Ti powders by powder metallurgy method. Biomaterials 23 (2002) 2909-2915.
Ning, C. Q; Zhou, Y.”Correlations between the in vitro and in vivo bioactivity of the Ti/HA composites fabricated by a powder metallurgy method”. Acta Biomaterialia 4 (2008) 1944-1952.