Sir,
carcinomas escamosos da pele (SCC) são tumores malignos frequentes da pele, com uma incidência de 30 por 100 000 habitantes por ano na Europa Ocidental. Em climas mais ensolarados são ainda mais frequentes. SCC geralmente se desenvolve a partir de queratoses actínicas. Para além da luz solar, outros factores predisponentes incluem radiação ionizante, inflamação crónica com cicatrizes, infecções virais e imunossupressão. Os doentes transplantados de órgãos têm um risco marcadamente aumentado, talvez 200 vezes, de desenvolver CSC, devido à sua terapêutica imunossupressora (1). O mesmo acontece com os pacientes com imunodeficiência devido a outros fatores, por exemplo, aqueles com infecção pelo HIV (1, 2). um homem de 50 anos apresentou um grande tumor na bochecha esquerda, que se desenvolveu nos últimos 3 meses. O tumor tinha uma fronteira elevada e uma úlcera Central. Ele tinha viajado na Tunísia 6 meses antes com muita exposição solar. Apesar de ter a pele do Fitzpatrick tipo II, nunca tinha praticado Protecção solar. O exame clínico não revelou outros sinais de lesão actínica; especificamente, não tinha queratoses actínicas. Desde a sua estadia na Tunísia, o paciente teve também uma tosse seca crónica. Os gânglios linfáticos cervicais estavam normais com palpação e com ecografia. A tomografia por ressonância magnética não mostrou infiltração de estruturas adjacentes de tecidos moles. Devido ao rápido crescimento do tumor e sua aparência macroscópica, suspeitamos de queratoacantoma. O exame histológico revelou uma CSC bem diferenciada, mas ulcerada. A análise citométrica do fluxo das células T periféricas revelou um desequilíbrio, com apenas 5 células CD4+/CD3+e 226 células CD8+/CD3+ (razão 0, 02), indicando imunodeficiência e, talvez, explicando o rápido crescimento do tumor. Apesar do aconselhamento extensivo sobre uma doença imunossupressora potencialmente subjacente, o doente rejeitou outros procedimentos de diagnóstico do VIH, bem como estudos adicionais para clarificar a tosse (suspeita de pneumonia por Pneumocystis jiroveci) e excluir metástases. Ele também rejeitou a re-excisão com margens maiores e deixou o hospital contra o conselho médico.

Fig. 1. A bochecha esquerda de um homem de 50 anos com um tumor grande. A) aspecto Dorsal e B) aspecto lateral.
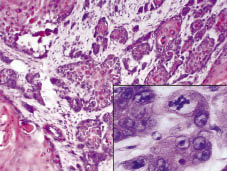
Fig. 2. A investigação histológica revelou um tumor infiltrado, destruindo as estruturas anatómicas lesionais. Inserir: o tumor é composto por queratinócitos polimórficos com várias mitoses (H&e ×200, com ampliação digital).
discussão
Keratoacanthoma (KA) foi descrito pela primeira vez em 1889 por Jonathan Hutchinson como úlcera crateriforme da face. Apresenta-se mais frequentemente como um tumor cutâneo em rápido crescimento em áreas expostas ao sol (3). Os homens são afetados cerca de 3 vezes mais do que as mulheres. A distribuição etária ajustada mostra que é mais frequente na meia idade e não aumenta a incidência em pessoas idosas (ao contrário do carcinoma basocelular e SCC) (4). Enquanto SCC se desenvolve a partir do epitélio superficial, KAs são derivadas da parede folicular do cabelo logo acima onde o ducto sebáceo entra. São uma entidade distinta com características clínicas e histológicas específicas (5). A tendência para a regressão espontânea e o extenso grau de queratinização são as características mais marcantes, juntamente com a típica arquitetura simétrica do tumor (6).
a nosologia e classificação exatas de KA são uma questão de debate. Alguns autores consideram KA como um tumor cutâneo benigno que é o protótipo dos tumores” pseudomalignantes ” da pele, enquanto outros sustentam que é neoplasma Maligno – uma variante peculiar da CCC – e, portanto, deve ser tratado como SCC (7-9). As dificuldades de diagnóstico são especialmente verdadeiras para as variantes destrutivas e persistentes de KA, como KA gigante ou mutilando KA. Clinicamente, KA é diferenciada do SCC por sua história de rápido crescimento e sua forma vulcânica. No entanto, no caso descrito aqui, um grande SCC também mostrou um crescimento muito rápido, possivelmente por causa da infecção pelo HIV. Por vezes, as lesões consideradas como KAs têm de ser reclassificadas como SCCs com base no seu curso clínico subsequente. Além de um diagnóstico errado, outras explicações são a combinação de KA e SCC, bem como a transformação de KA em SCC. Além disso, algumas KAs podem ser variantes bem diferenciadas do SCCs, como proposto por Ackerman (10-12).devido às dificuldades em distinguir entre KA e SCC, o tratamento de escolha para todos os tipos de KAs ainda é excisão cirúrgica com verificação histopatológica do diagnóstico (8-10). Se a cirurgia é impossível, a radiação ionizante pode ser considerada. Várias outras opções terapêuticas, como a tópica de 5-fluorouracil, intra-lesionada injeções de interferon-alfa, metotrexato, ou bleomicina e administrado sistemicamente retinóides, tem sido relatado para ser eficaz em casos individuais, mas não há ensaios clínicos controlados demonstrando a eficiência desses tratamentos (1, 4, 5). alguns CCSC podem crescer rapidamente, imitando uma KA, como no caso descrito aqui. A razão para o rápido crescimento do KAs não é clara; várias hipóteses foram oferecidas, incluindo imunossupressão e exposição à luz solar excessiva. KAs, especialmente aqueles que não podem ser claramente distinguidos da CSC, devem ser tratados por ampla excisão cirúrgica, uma vez que eles podem ter um prognóstico desfavorável com o desenvolvimento precoce de metástases. 1. Sterry W, Stockfleth E. Maligne epitheliale Tumore. In: Braun-Falco o, Plewig G, Wolff HH, Burgdorf WH, Landthaler m, editors. Dermatologie und Venerologie. 5th edn. Heidelberg: Springer, 2005: p. 1267-1276.2. Nguyen P, Vin-Christian K, Ming ME, Berger T. carcinomas de células escamosas agressivos em pessoas infectadas com o vírus da imunodeficiência humana. Arch Dermatol 2002; 138: 758–763.3. Rinker MH, Fenske na, Scalf LA, Glass if. Variantes histológicas do carcinoma escamoso da pele. Cancer Control 2001; 8: 354-363.4. Mac Kie RM, Quinn AG. Não melanoma cancro da pele e tumores epidérmicos. In: Burns T, Breathnack S, Cox N, Griffiths C, editors. O livro de dermatologia da torre. 7th edn. Massachusetts: Blackwell Science, 2004: p. 43-46.5. Kurschat P, Hess S, Hunzelmann N, Scharffetter-Kochanek K. Keratoacanthoma centrifugum marginatum, acompanhada por uma extensa reacção granulomatosa do corpo estranho. Dermatol Online J 2005; 11: 16.6. Bayer-Garner IB, Ivan D, Schwartz MR, Tschen JA. A imunopatologia da regressão na queratose líquenóide benigna, queratoacantoma e halo nevus. Clin Med Res 2004; 2: 89-97.7. Cribier B, Asch P, Grosshans E. diferenciando o carcinoma de células escamosas do queratoacantoma utilizando critérios histopatológicos. É possível? Um estudo de 296 casos. Dermatology 1999; 199: 208-212.8. Beham A, Regauer S, Soyer HP, Beham-Schmid C. Keratoacanthoma: a clinically distinct variant of well differentic cell carcinoma. Adv Anat Pathol 199; 5: 269-280.9. Warner DM, Flowers F, Ramos-Caro FA. Queratoacantoma solitário( carcinoma de células escamosas): tratamento cirúrgico. Int J Dermatol 1995; 34: 17-19.10. Hodak e, Jones RE, Ackerman AB. Queratoacantoma solitário é um carcinoma de células escamosas: três exemplos com metástases. Am J Dermatopathol 1993; 15: 332-342.11. Sanchez YE, Simon P, Requena L, Ambrojo P, de Eusebio E. Solitary keratoacanthoma: a self-healing proliferation that frequently becomes Maligne. Am J Dermatopathol 2000; 22: 305-310.12. Lawrence N, Reed RJ. Queratoacantoma actínico. Especulações sobre a natureza da lesão e o papel da imunidade celular em sua evolução. Am J Dermatopathol 1990; 12: 517-533.