Cinética Química
Cinética Química
pode estar familiarizado com as titulações ácido-base que utilizam fenolftaleína como indicador de endpoint. Você pode não ter notado, no entanto, o que acontece quando uma solução que contém fenolftaleína na presença de excesso de base é permitido para representar um fewminutes. Embora a solução inicialmente tenha uma cor rosa, ela gradualmente se torna incolor à medida que a fenolftaleína reage com o íon OH em uma solução Fortemente Básica.
a tabela abaixo mostra o que acontece com a concentração de fenolftaleinina uma solução que foi inicialmente de 0, 005 M na fenolftaleína e 0, 61 M no íon OH. Como você pode ver, quando esses dados são plotados no gráfico abaixo, a desconcentração fenolftaleoconcentração diminui em um fator de 10 ao longo de um período de cerca de quatro minutos.
Experimental Data for the Reaction Between Phenolphthalein and ExcessBase
| Concentration of Phenolphthalein (M) |
Time (s) | |
| 0.0050 | 0.0 | |
| 0.0045 | 10.5 | |
| 0.0040 | 22.3 | |
| 0.0035 | 35.7 | |
| 0.0030 | 51.1 | |
| 0.0025 | 69.3 | |
| 0.0020 | 91.6 | |
| 0.0015 | 120.4 | |
| 0.0010 | 160.9 | |
| 0.00050 | 230.3 | |
| 0.00025 | 299.6 | |
| 0.00015 | 350.7 | |
| 0.00010 | 391.2 |
Experimentos como o que nos deu os dados da tabela acima, areclassified como medidas de cinética química (do grego-tronco que significa “tomove”). Um dos objetivos destas experiências é descrever a taxa de reação a que os reagentes são transformados nos produtos da reação.
a taxa de termo é frequentemente utilizada para descrever a variação de uma quantidade que ocorre por unidade de tempo. A taxa de inflação, por exemplo, é a variação do custo médio de uma recolha de itens padrão por ano. A taxa a que um objeto percorre o espaço é a distância percorrida por unidade de tempo, como Milhas por hora ou quilômetros por segundo. Em cinética química, a distância percorrida é a mudança na concentração de um dos componentes da reação. A velocidade de uma reacção istherefore a alteração na concentração de um dos reagentes![]() (X)
(X)![]() que ocorre durante um determinado período de tempo
que ocorre durante um determinado período de tempo![]() t.
t.
![]()
a Prática de Problema 1:
Utilizar os dados na tabela acima, para calcular a taxa de fenolftaleína reage com o OH – ion durante cada um dos períodos seguintes:
(a) Durante o primeiro intervalo de tempo, quando a fenolftaleína concentração cai de 0.0050 M 0.0045 M.
(b) Durante o segundo intervalo, quando a concentração cai de 0.0045 M 0.0040 M.
(c), Durante o terceiro intervalo, quando a concentração cai de 0.0040 M 0.0035 M.
Clique aqui para verificar a sua resposta para a Prática do Problema 1.Clique aqui para ver uma solução para o problema de Prática 1.
![]()
Taxas instantâneas de reação e o RateLaw para uma reação
A taxa da reação entre fenolftaleína e o íon OH não é constante; ela muda com o tempo. Como a maioria das reações, a taxa desta reação diminui gradualmente à medida que os reagentes são consumidos. Isto significa que a taxa de reação se altera enquanto está sendo medida.
para minimizar o erro que isto introduz nas nossas medições, parece aconselhável medir a taxa de reacção ao longo de períodos de tempo que são curtos em comparação com o tempo que leva para que a reacção ocorra. Podemos tentar, por exemplo, para measurethe infinitamente pequena mudança na concentração de![]() d(X)
d(X)![]() , que ocorre através de um infinitamente curto período de timedt. A razão dasequantidades é conhecida como a taxa instantânea de reação.
, que ocorre através de um infinitamente curto período de timedt. A razão dasequantidades é conhecida como a taxa instantânea de reação.
![]()
A taxa instantânea de reação em qualquer momento no tempo pode ser calculatedfrom um gráfico da concentração do reagente (ou produto) versus tempo. O gráfico abaixo mostra como a taxa de reação para a decomposição de fenolftaleína pode ser calculada a partir de um gráfico de concentração versus tempo. A taxa de reação em qualquer momento da momentina é igual à inclinação de uma tangente traçada para esta curva naquele momento.
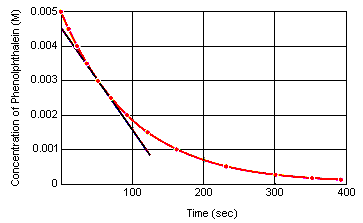
a taxa instantânea de reacção pode ser medida a qualquer momento entre o momento em que os reagentes são misturados e a reacção atinge o equilíbrio.Extrapolar estes dados para o momento em que os reagentes são misturados dá a taxa inicial de reacção instantânea.
![]()
Rate Laws and Rate Constants
um resultado interessante é obtido quando a taxa instantânea de reação é calculada em vários pontos ao longo da curva no gráfico da secção anterior. A taxa de reacção em cada ponto desta curva é directamente proporcional à concentração de fenolftaleína nesse momento.
Rate = k(phenolphthalein)
Because this equation is an experimental law that describes the rate of reaction, it is called the rate law for the reaction. The proportionalityconstant, k, is known as the rate constant.
Practice Problem 2:
Calculate the rate constant for the reaction between phenolphthalein and the OH – ion if the instantaneous rate of reaction is 2.5 x 10-5 mol por litro por segundo quando a concentração de fenolftaleína é de 0, 0025 M.
Clique aqui para verificar a sua resposta ao problema de Prática 2.Clique aqui para ver uma solução para o problema de Prática 2.
Practice Problem 3:
Use the rate constant for the reaction between phenolphthalein and the OH – ion to calculate the initial instantaneous rate of reaction for the experimental data listed in the preceding table.
Clique aqui para verificar a sua resposta ao problema de Prática 3.Clique aqui para ver uma solução para o problema de Prática 3.
![]()
diferentes maneiras de expressar a taxa de reação
geralmente há mais de uma maneira de medir a taxa de reação. Podemos estudar a decomposição do iodeto de hidrogênio, por exemplo, medindo a taxa em que H2 ou I2 é formado na reação seguinte ou terato em que HI é consumido.
2 HI(g) H2(g) + I2(g)
experimentalmente descobrimos que a taxa a que I2 é formado é proportional ao quadrado da concentração de HI a qualquer momento no tempo.
![]()
O que aconteceria se estudássemos a taxa a que H2 é formado?A equação equilibrada sugere que H2 e I2 devem ser formados atexactamente a mesma taxa.
O que aconteceria, no entanto, se estudássemos a taxa a que HI é consumida nesta reacção? Como o HI é consumido, a mudança na sua concentração deve ser um número negativo. Por convenção, a taxa de uma reacção é sempre relatada como um número positivo. Por conseguinte, temos de alterar o sinal antes de comunicar a taxa de reacção do areactante que é consumido na reacção.
![]()
o sinal negativo faz duas coisas. Matematicamente, converte uma mudança negativa na concentração de HI em uma taxa positiva. Fisicamente, lembra – nos que a concentração do reagente diminui com o tempo.
Qual é a relação entre a taxa de reacção obtida por monitorização da formação de H2 ou I2 e a taxa obtida por arrastamento de HI desaparecer? A estequiometria da reação diz que duas moléculas HI areconsumadas para cada molécula de H2 ou I2 produzida. Isto significa que a taxa de decomposição de HI é duas vezes mais rápida que a taxa a que H2 e I2are se formaram. Podemos traduzir esta relação numa equação matemática como se segue.
![]()
como resultado, a constante de taxa obtida a partir do estudo da taxa a que H2 e I2 são formados nesta reacção (k) não é a mesma que a constante de taxa obtida por monitorização da taxa a que HI é consumido (k’)
problema de prática 4:
Calcular a taxa em que a OI desaparece na seguinte reação no momento em que I2 é formada a uma taxa de 1,8 x 10-6 moles por litro por segundo:
2 HI(g) ![]() H2(g) + I2(g)
H2(g) + I2(g)
Clique aqui para verificar a sua resposta para a Prática do Problema 4.Clique aqui para ver uma solução para o problema de prática 4.
![]()
A Taxa Lei Versus a Estequiometria de aReaction
Na década de 1930, Sir Christopher Ingold e colegas de trabalho na Universidade ofLondon estudou a cinética das reações de substituição, tais como o seguinte.
CH3Br(aq) + OH-(aq)
CH3OH(aq) + Br-(aq)
Eles descobriram que a taxa desta reação é proporcional à theconcentrations de ambos os reagentes.
Rate = k(CH3Br)(OH -)
When they ran a similar reaction on a slightly different startingmaterial, they got similar products.
(CH3)3CBr(aq) + OH-(aq)![]() (CH3)3COH(aq) + Br-(aq)
(CH3)3COH(aq) + Br-(aq)
Mas, agora, a taxa de reação foi proporcional à concentração de apenas um dos reagentes.
Rate = k ((CH3)3CBr)
estes resultados ilustram um ponto importante: a lei de taxa para areacção não pode ser prevista a partir da estequiometria da reacção; deve ser determinadaexperimentalmente. Às vezes, a lei da taxa é consistente com o que esperamos da estequiometria da reação.
2 HI(g) H2(g) + I2(g)
Rate = k(HI)2
Often, however, it is not.
| 2 N2O5(g) |
Taxa = k(N2O5) |
![]()
a Fim de Molecularity
Algumas reações ocorrem em uma única etapa. A reação em que uma clorinatomáceas é transferida de ClNO2 para NO para formar NO2 e ClNO é um bom exemplo de uma reação de um passo.
ClNO2(g) + NO(g)
NO2(g) + ClNO(g)
Other reactions occur by a series of individual steps. N2O5,for example, decomposes to NO2 and O2 by a three-step mechanism.
| Step 1: | N2O5 |
|
| Passo 2: | NO2 + NO3 |
|
| Passo 3: | NÃO + NO3 |
As etapas de uma reação são classificados em termos de molecularity,que descreve o número de moléculas consumida. Quando uma unimolécula é consumida, o passo é chamado unimolecular. Quando duas moléculas são reconsumidas, é bimolecular.
Practice Problem 5:
Determine the molecularity of each step in the reaction by which N2O5 decomposes to NO2 and O2.
Clique aqui para verificar a sua resposta ao problema de prática 5.Clique aqui para ver uma solução para o problema de prática 5.
reações também podem ser classificadas em termos de sua ordem. A decomposição de N2O5 é uma reacção de primeira ordem porque a taxa de reacção depende da concentração de N2O5 elevada ao primeiro poder.
Rate = k (N2O5)
A decomposição de HI é uma reacção de segunda ordem porque a taxa de reacção depende da concentração de HI elevada à segunda potência.
Rate = k(HI)2
Quando a taxa de uma reação depende de mais do que onereagent, classificamos a reação em termos da ordem de cada reagente.
a Prática do Problema 6:
Classificar a ordem da reação entre o no e O2 para formar NO2:
2 NO(g) + O2(g) ![]() 2 NO2(g)
2 NO2(g)
Suponha a seguinte taxa lei para esta reação:
Rate = k(no)2(O2)
Clique aqui para verificar a sua resposta ao problema de prática 6.
a diferença entre a Molecular e a ordem de uma reacção é importante. A Molecular de uma reação, ou um passo dentro de uma reação,descreve o que acontece no nível molecular. A ordem de uma reação descreve o que acontece na escala macroscópica. Nós determinamos a ordem de uma reação observando os produtos de uma reação aparecerem ou os reagentes desaparecerem. A Molecular da reação é algo que deduzimos para explicar estes resultados experimentais.
![]()
modelo da teoria da colisão de reações químicas
O modelo da teoria da colisão de reações químicas pode ser usado para explicar as leis de taxa observadas tanto para as reações de uma etapa como para as de várias etapas. Este modelassuma que a taxa de qualquer etapa de uma reacção depende da frequência de colisões entre as partículas envolvidas nessa etapa.
A figura abaixo fornece uma base para a compreensão das implicações do modelo da teoria da colisão para reações simples, de uma só etapa, como o seguinte.
ClNO2(g) + NO(g) ![]() NO2(g) + ClNO(g)
NO2(g) + ClNO(g)

A cinética molecular, a teoria assume que o número de colisões persecond em um gás depende do número de partículas por litro. A taxa a que o NO2 e o ClNO são formados nesta reacção deve, por conseguinte, ser directamente proporcional às concentrações do ClNO2 e do NO.
Rate = k(ClNO2) (NO)
The collision theory model suggests that the rate of any step in areaction is proportional to the concentrations of the reagents consumed in that step. A lei do Estado para uma reação de um passo deve, portanto, concordar com a estequiometria da ação.
a seguinte reacção, por exemplo, ocorre numa única etapa.
CH3Br(aq) + OH-(aq) ![]() CH3OH(aq) + Br-(aq)
CH3OH(aq) + Br-(aq)
Quando estas moléculas colidem na orientação correta, um par ofnonbonding elétrons no OH – íon pode ser doado para o átomo de carbono na thecenter do CH3Br molécula, como mostrado na figura abaixo.

Quando isto acontece, uma ligação carbono-oxigénio forma-se ao mesmo tempo que a ligação carbono-bromo é quebrada. O resultado líquido desta reação é a substituição de ano – íon por um íon – Br. Porque a reação ocorre em um único passo, que envolve colisões entre os dois reagentes, a taxa desta reação é proposicional para a concentração de ambos reagentes.
taxa = k(CH3Br)(OH -)
nem todas as reacções ocorrem numa única etapa. A reacção seguinte ocorre em três etapas, como se pode ver na figura abaixo.
(CH3)3CBr(aq) + OH-(aq)![]() (CH3)3COH(aq) + Br-(aq)
(CH3)3COH(aq) + Br-(aq)

Na primeira etapa, o (CH3)3CBr moleculedissociates em um par de íons.
| Primeira etapa |  |
A carga positiva (CH3)3C+ ion thenreacts com água em uma segunda etapa.
| Segunda etapa |  |
O produto dessa reação, em seguida, perde um próton para o OH-ion ou de água na etapa final.
| Terceira etapa |  |
a segunda e A terceira etapas nesta reação são muito mais rápido thanfirst.
| (CH3)3CBr |
Slow step | |
| (CH3)3C+ + H2O |
Fast step | |
| (CH3)3COH2+ + OH- |
Fast step |
The overall rate of reaction is therefore more or less equal to the rateof the first step. O primeiro passo é, portanto, chamado de passo limitante de taxa nesta reação porque ele literalmente limita a taxa a que os produtos da reação podem ser formados. Uma vez que apenas um reagente está envolvido no passo limitador de velocidade, a taxa de reação é proporcional à concentração de apenas este reagente.
Rate = k ((CH3)3CBr)
A Lei de taxa para esta reação, portanto, difere do que nós queremos evitar Da estequiometria da reação. Embora a reação consuma ambos (CH3)3CBrand OH -, a taxa da reação é apenas proporcional à concentração de(CH3)3Cbr.as leis da taxa de reacções químicas podem ser explicadas pelas seguintes regras gerais.
A taxa de qualquer etapa de uma reação é diretamente proporcional às concentrações dos reagentes consumidos na etapa.
A Lei Geral da taxa para uma reacção é determinada pela sequência de passos, ou pelo mecanismo, pelo qual os reagentes são convertidos nos produtos da reacção.
A Lei Geral de taxa para uma reação é dominada pela lei de taxa para o passo mais lento na reação.
