dipoli
pentru a înțelege natura interacțiunilor necovalente, trebuie mai întâi să ne întoarcem la legăturile covalente și să aprofundăm subiectul dipolilor. Multe dintre legăturile covalente pe care le – am văzut –între doi atomi de carbon, de exemplu, sau între un carbon și un hidrogen-implică împărțirea aproximativ egală a electronilor între cei doi atomi din legătură. În aceste exemple, cei doi atomi au aproximativ aceeași electronegativitate. Amintiți-vă de la cursul dvs. de chimie generală că electronegativitatea se referă la” puterea unui atom dintr-o moleculă de a atrage electroni la sine ” (aceasta este definiția oferită de Linus Pauling, eminentul chimist American din secolul 20, care a fost în primul rând responsabil pentru dezvoltarea multor concepte de legătură pe care le-am învățat).cu toate acestea, destul de des în chimia organică avem de-a face cu legături covalente între doi atomi cu electronegativități diferite, iar în aceste cazuri împărțirea electronilor nu este egală: Nucleul mai electronegativ îi apropie pe cei doi electroni. În legătura carbon-oxigen a unui alcool, de exemplu, cei doi electroni din legătura sigma sunt ținuți mai aproape de oxigen decât de carbon, deoarece oxigenul este semnificativ mai electronegativ decât carbonul. Același lucru este valabil și pentru legătura oxigen-hidrogen, deoarece hidrogenul este puțin mai puțin electronegativ decât carbonul și mult mai puțin electronegativ decât oxigenul.
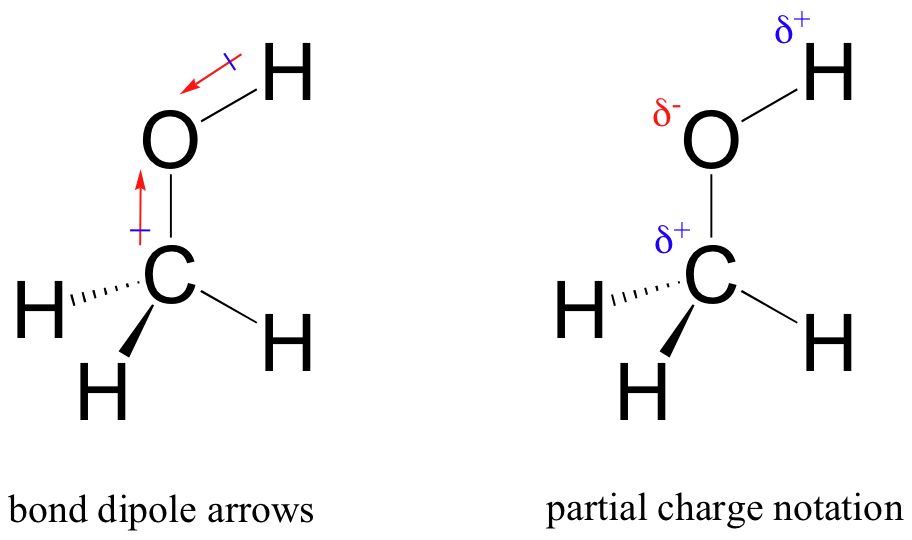
rezultatul acestei împărțiri inegale este ceea ce numim un dipol de legătură, care există într-o legătură covalentă polară. Un dipol de legătură are atât capete negative, cât și pozitive, sau poli, unde densitatea electronilor este mai mică (polul pozitiv) și mai mare (polul negativ). Diferența de densitate a electronilor poate fi exprimată folosind litera greacă delta pentru a desemna încărcarea parțială pozitivă și parțială negativă a atomilor. ‘Săgețile dipol’, cu un semn pozitiv pe coada, sunt de asemenea folosite pentru a indicat negativ (densitate mai mare de electroni) direcția de dipol.
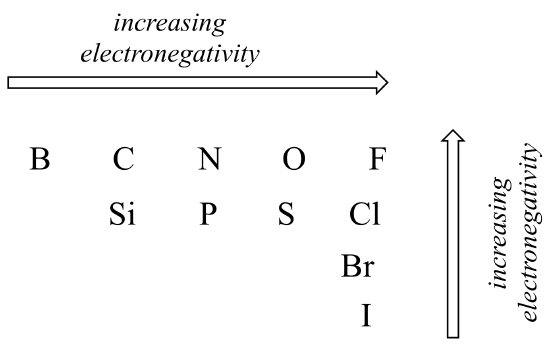
gradul de polaritate într-o legătură covalentă depinde de diferența de electronegativitate dintre cei doi atomi. Electronegativitatea este o tendință periodică: crește mergând de la stânga la dreapta pe un rând al tabelului periodic al elementelor și, de asemenea, crește pe măsură ce urcăm o coloană. Prin urmare, oxigenul este mai electronegativ decât azotul, care este la rândul său mai electronegativ decât carbonul. Oxigenul este, de asemenea, mai electronegativ decât sulful. Fluorul, în colțul din dreapta sus al tabelului periodic, este cel mai electronegativ dintre elemente. Hidrogenul este puțin mai puțin electronegativ decât carbonul.
tendințe periodice în electronegativitate
exercițiul 2.26
folosind ceea ce aveți despre orbitalii atomici, raționalizați tendințele periodice în electronegativitate. De ce crește de la stânga la dreapta și scade de sus în jos? Aceasta este o întrebare bună pentru a vorbi cu colegii de clasă și cu un instructor sau tutore.
soluții la exerciții
majoritatea moleculelor conțin atât legături covalente polare, cât și nepolare. În funcție de locația legăturilor polare și a geometriei de legătură, moleculele pot avea o polaritate netă, numită moment dipol molecular. Apa, după cum probabil vă amintiți, are un moment dipol care rezultă din dipolii combinați ai celor două legături oxigen-hidrogen. Fluorometanul are, de asemenea, un moment dipol.
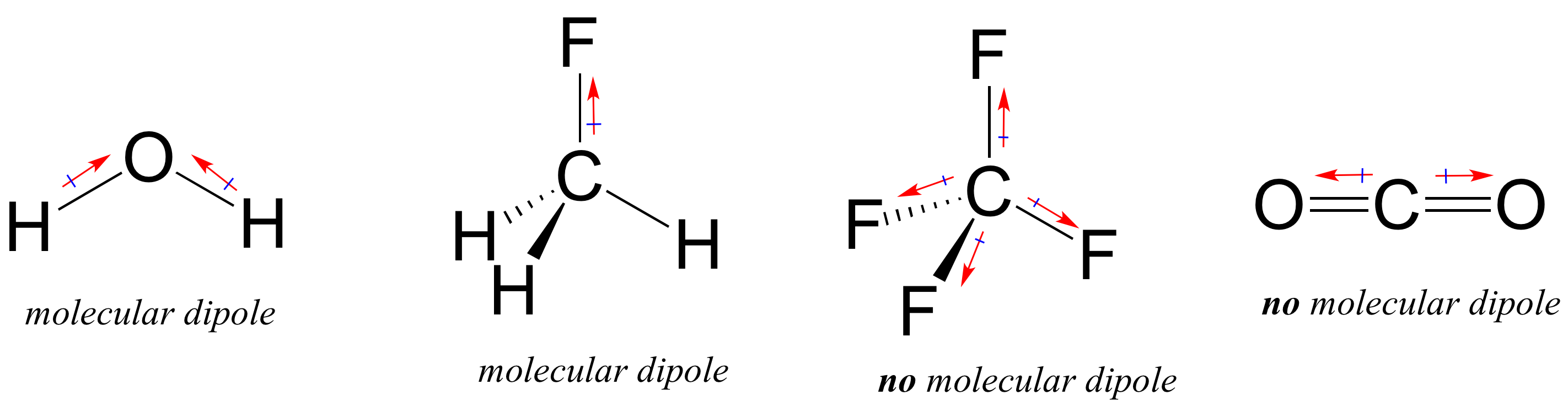
Tetrafluormetanul, cu toate acestea, are patru legături polare care trag în mod egal în cele patru colțuri ale unui tetaedru, ceea ce înseamnă că, deși există patru dipoli de legătură, nu există un moment dipol molecular global. Dioxidului de Carbon îi lipsește, de asemenea, un moment dipol molecular.
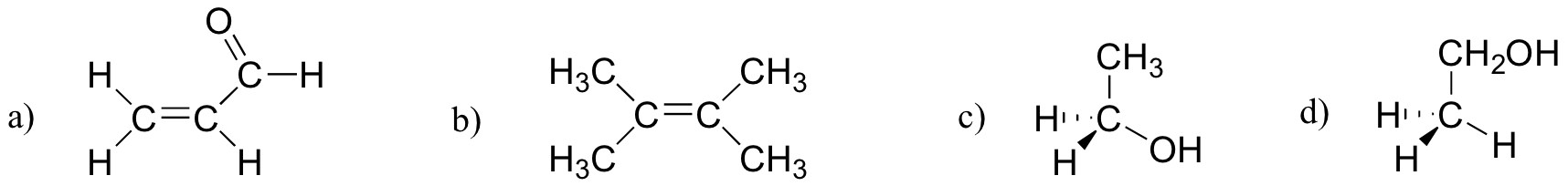
exercitiul 2.27
care dintre moleculele de mai jos au momente moleculare dipol?
soluții la exerciții