Facts, Summary & Definition
- un aduct este un produs format dintr-o reacție de adiție
- Aductele pot fi formate numai din reactanți care au legături multiple, cum ar fi alchene și grupări carbonil
- Aductele pot fi formate reacție: electrofil și nucleofil
- aducții se formează adesea între acizii Lewis și bazele Lewis
Ce este un aduct?
un aduct este un produs format la sfârșitul unei reacții de adăugare. Aceasta este o reacție în care două sau mai multe molecule reacționează și se combină pentru a forma un produs mai mare. Acest tip de reacție poate apărea numai între compuși chimici care au legături multiple – compuși precum alchene (legături duble) și alchine (legături triple). Carbonil (c=o) și imină (c=N) grupurile pot suferi, de asemenea, reacții de adiție și, astfel, formează aducți.
cum se formează aducții?
după cum am menționat anterior, aducții se formează prin reacții de adiție. În acest tip de reacție, dubla legătură se rupe parțial atunci când o moleculă care reacționează atacă și se adaugă. Reacția de mai jos prezintă o reacție de adiție între etenă și brom.

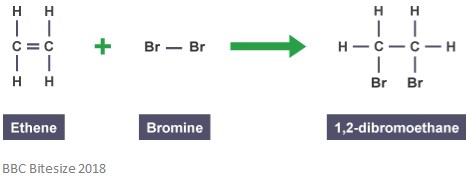
aductul în această reacție este 1,2-dibromoetan. Acest lucru se datorează faptului că este o specie distinctă care conține toți atomii tuturor componentelor.
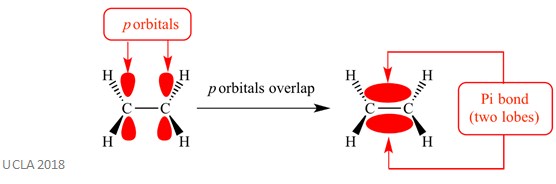
aceste reacții de adiție implică, de obicei, legături pi (XV). Acesta este un tip complex de legătură în care orbitalii p de pe atomii adiacenți se suprapun – această suprapunere provoacă legătura pi. Acest lucru are loc perpendicular pe orice legături sigma între acești doi atomi de aceeași. Această legătură pi are, de asemenea, doi lobi orbitali – unul este deasupra planului legăturii sigma, iar celălalt este sub planul legăturii sigma. Legătura pi este prezentată în diagrama de mai jos.

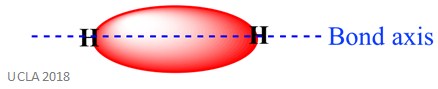
aceeași reacție poate implica, de asemenea, legături sigma (inkt). Acesta este un tip de formă de legătură covalentă prin suprapunerea orbitalilor atomici de – a lungul axei legăturii-cu alte cuvinte, de-a lungul liniei care leagă cei doi atomi legați. De exemplu, legătura sigma într – un atom de hidrogen este formată prin suprapunerea a doi orbitali 1s-unul din fiecare atom de hidrogen. Acest lucru este mai bine arătat în imaginea de mai jos – zona roșie afișată legătura sigma.

există două tipuri principale de reacție de adiție: Adăugare electrofilă și adăugare nucleofilă.
Adăugare electrofilă
o reacție de adăugare electrofilă este un tip de reacție în care o legătură este ruptă și se formează două noi legături. Așa cum am discutat mai devreme, reactantul trebuie să aibă o legătură dublă sau triplă – electrofilul se adaugă la o legătură pi în acest caz. Aceasta este o reacție de adiție și, prin urmare, nu se pierde nimic în acest proces – toți atomii găsiți în moleculele reactante se găsesc și în aduct.

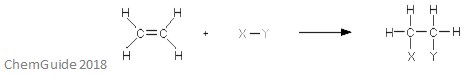
imaginea de mai sus prezintă elementele de bază ale unei reacții de adiție electrofilă. După cum puteți vedea, toți atomii din reactanți se găsesc în aduct.
Adăugare nucleofilă
o reacție de adăugare nucleofilă este un tip de reacție în care se rupe o legătură dublă și se formează două legături simple. O legătură dublă sau triplă cu deficit de electroni (electrofil) reacționează cu ceva bogat în electroni (nucleofil). Nucleofilul se adaugă la o legătură pi în acest caz. Un exemplu de reacție de adiție nucleofilă este prezentat mai jos.

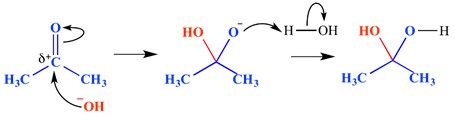
În acest exemplu, un ion hidroxid s – a adăugat la capătul delta pozitiv al grupării carbonil-aceasta a format o moleculă intermediară tetraedrică oxianionică. Rezultatul final este, prin urmare, adăugarea de apă peste legătura pi a grupării carbonil.
acizii Lewis și bazele Lewis
Aducții sunt adesea cunoscuți pentru a se forma între acizii Lewis și bazele Lewis. Molecula formată se numește aduct acid-bază Lewis (sau un complex acid-bază Lewis). Deoarece adductele se formează numai prin reacții de adiție (adică fără pierderea simultană a unui grup), reacțiile Lewis-acid și Lewis-bază nu pot fi cele de tip substituție.
un bun exemplu în acest sens este reacția dintre THF și BH3, care este prezentată în imaginea de mai jos. După cum veți vedea, aceste aducte de bază Lewis acid-Lewis sunt prezentate cu puncte – acestea reprezintă electroni.

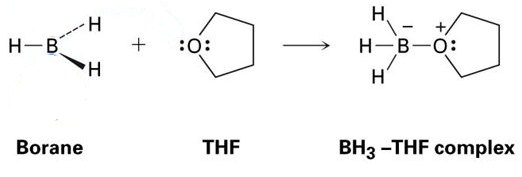
după cum puteți vedea, singurul produs format este complexul BH3-THF, ceea ce înseamnă că este un aduct.
aceste tipuri de reacții pot fi descrise și cu săgeți – aceste săgeți reprezintă donarea de electroni de la bază la acid. Aceeași reacție este prezentată mai jos, dar cu săgeți pentru a indica donarea de electroni.

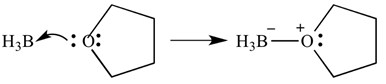
este important să rețineți aici că aceste săgeți au două „ghimpi” la capătul ascuțit. Aceasta indică faptul că o pereche de electroni a fost donată. Dacă este donat un singur electron, săgeata va avea doar un bard pe capătul ascuțit.
în acest caz, acidul Lewis este Boran și baza Lewis este THF. După cum puteți vedea, baza a donat o pereche singură de electroni acidului pentru a forma o legătură oxigen-bor.
compușii care nu sunt capabili să formeze aducți din cauza formei moleculelor se numesc perechi Lewis frustrate.
lecturi suplimentare
http://www.chem.ucla.edu/~harding/IGOC/L/lewis_acid_base_adduct.html