Fiziopatologie VIVO
alte subiecte
Aquaporins: canale de apă
apa traversează membranele celulare prin două căi: prin difuzie prin bistratul lipidic și prin canale de apă numite acvaporine. Caracterizarea funcțională a primului aquaporin a fost raportată în 1992, dar canalele de apă au fost suspectate că există cu mult înainte de acel moment, deoarece permeabilitatea osmotică a unor tipuri de celule epiteliale a fost mult prea mare pentru a fi contabilizată prin simpla difuzie prin membrana plasmatică.
un singur canal uman aquaporin-1 facilitează transportul apei la o rată de aproximativ 3 miliarde de molecule de apă pe secundă. Un astfel de transport pare a fi bidirecțional, în conformitate cu gradientul osmotic predominant.acvaporinele clasice transportă apa fără substanțe dizolvate prin membranele celulare; ele par a fi canale de apă exclusive și nu pătrund în membrane către ioni sau alte molecule mici. Unele acvaporine-cunoscute sub numele de aquagliceroporine – transportă apă plus glicerol și alte câteva molecule mici.
familia Aquaporinelor
Mai mult de 10 acvaporine de mamifere diferite au fost identificate până în prezent și se suspectează existența unor membri suplimentari. Proteinele canalului de apă strâns legate au fost izolate de plante, insecte și bacterii. Aquaporin-1 din celulele roșii din sânge uman a fost primul care a fost descoperit și este probabil cel mai bine studiat.
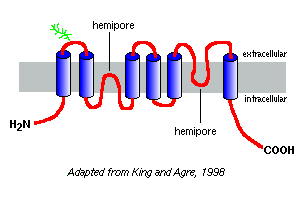
parcelele de hidrofobicitate ale secvențelor lor de aminoacizi prezic că acvaporinele au șase segmente de membrană, așa cum este descris în modelul aquaporin-1 din dreapta.
pe baza studiilor cu aquaporin-1, se pare că aquaporinele există în membrana plasmatică ca homotetrameri. Fiecare monomer aquaporin conține doi hemipori, care se pliază împreună pentru a forma un canal de apă.
diferitele acvaporine au modele diferite de glicozilare. În cazul aquaporin-1, coloana vertebrală a peptidei este de aproximativ 28 kDa, iar formele glicozilate variază de la 40 la 60 kDa în masă. Majoritatea acvaporinelor au o protein kinază un motiv de fosforilare într-una din buclele citoplasmatice, iar fosforilarea diferențială este suspectată empart o funcție de reglare a moleculei.
modele de Expresie Aquaporin
fiecare dintre aquaporins are un model esențial unic de exprimare între țesuturi și în timpul dezvoltării. Un rezumat al acestor atribute și al unora dintre funcțiile potențiale importante sau cunoscute este prezentat în următorul tabel:
| ochi: celule din fibră de lentile | echilibrul fluidelor din lentilă | |
| aquaporin-1 | celule roșii din sânge | protecție osmotică |
| rinichi: proximal tubule | Concentration of urine | Eye: ciliary epithelium | Production of aqueous humor | Brain: choriod plexus | Production of cerebrospinal fluid | Lung: alveolar epithelial cells | Alveolar hydration state |
| Aquaporin-2 | Kidney: collecting ducts | Mediates antidiuretic hormone activity |
| Aquaporin-3 * | Kidney: collecting ducts | Reabsorbtion of water into blood |
| Trachea: celulele epiteliale | secreția apei în trahee | |
| Aquaporin-4 | rinichi: conducte de colectare | reabsorbția apei |
| creier: celule ependimale | CSF echilibrul fluidelor | |
| creier: hipotalamus | funcția de osmosensing? | |
| Lung: epiteliu bronșic | secreție de lichid bronșic | |
| Aquaporin-5 | glandele salivare | producția de salivă |
| glandele lacrimale | producția de lacrimi | |
| Aquaporin-6 | rinichi | permeabilitate foarte scăzută a apei; funcție? |
| Aquaporin-7 * | celulele adipoase | transportă glicerol din adipocite |
| testicul și sperma | ||
| Aquaporin-8 | testicul, pancreas, ficat, altele | |
| aquaporin-9 * | leucocite | |
| * un aquagliceroporin | ||
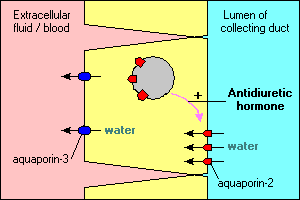
ar trebui să fie clar că aquaporinele sunt foarte răspândite și, de asemenea, că diferitele acvaporine au specialități diferite din punct de vedere funcțional.câteva caracteristici interesante și importante ale transportului de apă mediat de aquaporină sunt ilustrate în celulele principale care aliniază conductele de colectare din rinichi. Apa care curge prin aceste conducte poate continua și poate fi anulată în urină sau poate fi reabsorbită prin epiteliu și înapoi în sânge. Reabsorbția este în esență nulă, cu excepția cazului în care celulele epiteliale văd hormonul antidiuretic, care stimulează puternic reabsorbția apei. Celulele conductelor colectoare exprimă cel puțin două acvaporine:
- Aquaporin-2 este sintetizat, dar, în absența hormonului antidiuretic, se află într-un bazin de vezicule membranare din citoplasmă. Legarea hormonului antidiuretic la receptorul său din celulă nu numai că stimulează transcrierea genei aquaporin-2, dar determină introducerea bazinului intracelular al aquaporin-2 în membrana apicală. Celula este acum capabilă să preia eficient apa din lumenul conductei.
- Aquaporin-3 este exprimat constitutiv în membrana bazolaterală a celulei. Când apa inundă în celulă prin canalele aquaporin-2, Aceasta poate ieși rapid din celulă prin canalele aquaporin-3 și poate curge în sânge.
Aquaporinele și boala
având în vedere importanța transportului pe apă într-o multitudine de procese fiziologice, este de așteptat ca leziunile genelor aquaporinei sau disfuncția dobândită în aquaporine să poată provoca sau contribui la mai multe stări de boală. Căutarea unor astfel de conexiuni este încă timpurie, dar două exemple clare de boală au fost identificate ca fiind rezultate din deficiența acvaporinelor:
- mutațiile genei aquaporin-2 provoacă insipid diabet nefrogen ereditar la om.șoarecii homozigoți pentru inactivarea mutațiilor din gena aquaporin-0 dezvoltă cataractă congenitală.
- obezitatea cu debut Adult se dezvoltă la șoareci homozigoți pentru inactivarea mutațiilor în gena aquaporin-7, probabil datorită ineficienței în transportul glicerolului din depozitele de trigliceride hidrolizate.
un număr mic de persoane au fost identificate cu deficit sever sau total de aquaporin-1. Interesant, ele par clinic neafectate, dar nu au fost examinate în condiții de privare de apă. Șoarecii cu ștergeri vizate în aquaporin-1 par, de asemenea, normali și sănătoși, cu excepția cazului în care sunt restricționați de lichide, caz în care devin sever hiperosmolari.
referințe și recenzii
- Borgnia m, Nielsen s, Engel a, Agre P: Biologie Celulară și moleculară a canalelor de apă aquaporin. Annu Rev Biochem 68: 425, 1999.
- deGroot BL, Grubmuller H: permeabilitatea apei peste membranele biologice: mecanismul și dinamica aquaporin-1 și GlpF. Știință 294:2353, 2001.
- Hibuse T, Proc Nat Acad Sci (SUA) 102:10993, 2005.
- Regele LS, Agre P: Fiziopatologia canalelor de apă aquaporin. Annu Rev Physiol 58: 619, 1998.
- Knepper MA, Inoue T: reglarea traficului de canale de apă aquaporin-2 de către vasopresină. Opinia Curr Cell Biol 9: 560, 1997.
- Lee MD, Regele LS, Agre P: familia aquaporin de proteine de canal de apă în medicina clinică. Medicină 76: 141, 1997.
- Preston GM, Carroll TP, Guggino WP Agre P: apariția canalelor de apă în ovocitele Xenopus care exprimă proteina chip28 a celulelor roșii. Știință 256: 385, 1992.
- Sasaki s, Ishibashi K, Marumo F: Aquaporin-2 și -3: reprezentanți ai două subgrupe ale familiei aquaporin colocalizate în conducta de colectare a rinichilor. Annu Rev Physiol 60:199, 1998.