biomateriale
este posibilă delimitarea studiului biomaterialelor printr-o definiție foarte generală, dar coerentă, prin parcuri și lacuri . Potrivit acestora, un biomaterial poate fi definit ca orice material utilizat în fabricarea dispozitivelor pentru a înlocui o parte sau o funcție a corpului într-un mod sigur, fiabil, economic și fiziologic acceptabil.
pentru a îndeplini în mod satisfăcător funcția de înlocuire, mărire sau susținere a unei structuri, implantul trebuie să imite sau să se potrivească cu caracteristicile țesutului. Literatura raportează existența diferitelor tipuri de grefe osoase utilizate în implanturi: autolog (derivat de la același individ); omolog (de la un individ din aceeași specie a receptorului); și heterolog (atunci când speciile donatorului și primitorului nu sunt aceleași – bovine, de exemplu ).
grefele autologe au anumite dezavantaje, de exemplu: intervenție într-o zonă sănătoasă a corpului pacientului; morbiditatea zonei donatoare, perioada de recuperare mai mare; susceptibilitatea la infecții; și resorbție progresivă și constantă . Astfel, implanturile din biomateriale sintetice, cum ar fi ceramica și polimerii, au fost dezvoltate și aplicate pe scară largă. Potrivit Pereira, Buono și Zavaglia, cererea de biomateriale a crescut de la 5 la 15% în fiecare an.
clasificarea biomaterialelor
conform Bath și Santos , biomaterialele pot fi clasificate în patru clase, în funcție de compatibilitatea pe care o au cu țesuturile înconjurătoare:
Biotolerant: Implant separat de osul înconjurător printr-un strat de țesut moale peste interfață. Nici un contact în osteogeneză. Stratul este indus de eliberarea implantului de monomeri, ioni și/sau produse de coroziune. Aproape toți polimerii sintetici și majoritatea metalelor sunt această categorie.
Bioinert: Implanturi în contact direct cu țesutul osos, care apar implicarea în osteogeneza. Cu toate acestea, nu există nicio reacție chimică între țesut și implant. Nu există, cel puțin în cantități detectabile de celule, eliberarea vreunei componente. Exemple de biomateriale bioinert sunt: alumină, zirconiu, Titan, tantal, niobiu și carbon.
bioactiv: există interacțiunea dintre implant și țesutul osos, interferând direct în osteogeneză. Prin similitudine chimică, partea minerală a țesutului osos se leagă de implant, promovând osteoconducția. Principalele materiale din această clasă sunt: ca-fosfat, vitro-ceramică și hidroxiapatită.
bioresorbabil: materiale care, după o anumită perioadă de timp în contact cu țesuturile, ajung să fie degradate, solubilizate sau fagocitate de către organism. Ele sunt de interes în aplicații clinice în cazul în care este inadmisibil reoperation pentru a elimina implantul. Reprezentant al acestei clase sunt fosfatul tricalcic (TCP) și PLLA (acid poli-L-lactic).
biomateriale metalice
uneori, elementele metalice în formele lor naturale și în cantități mici sunt tolerate de organism, cum ar fi fierul (Fe) în celulele roșii din sânge, cobaltul (Co) în sinteza vitaminei B12 și în legăturile încrucișate ale elastinei prezente în artera aortică . Cu toate acestea, în cantități mari, majoritatea metalelor nu sunt tolerate de organism.
unele metale sunt folosite ca înlocuitori pentru țesuturile dure, de exemplu, în înlocuirile totale de șold și genunchi, plăci și șuruburi pentru fixarea fracturilor, dispozitive de fixare a coloanei și implanturi dentare datorită proprietăților mecanice excelente și rezistenței la coroziune . Potrivit lui Barbucci, un material metalic utilizat în construcția de proteze ortopedice, dispozitive de osteosinteză și implanturi dentare ar trebui să aibă următoarele caracteristici:
- rezistență limită egală sau mai mare de 800 MPa;
- rezistență la coroziune (locală și generală);
- biocompatibilitate.
biocompatibilitatea nu este un efect sau un fenomen unic. Se referă la o serie de procese care implică diferite mecanisme de interacțiune, dar interdependente în ceea ce privește materialele și țesuturile. Este capacitatea materialului de a îndeplini o funcție specifică în organism fără a provoca efecte toxice sau dăunătoare asupra sistemelor biologice .
aceste caracteristici sunt atât de restrictive încât doar un număr mic de clase de materiale metalice pot fi utilizate cu succes.
primul aliaj special dezvoltat pentru utilizarea în corpul uman a fost „oțelul de vanadiu”, utilizat pentru fabricarea plăcilor și șuruburilor pentru fracturi osoase . Printre biomaterialele metalice, oțelurile inoxidabile austenitice de tip 316 LVM, aliajele Co-Cr-Mo, Co-Ni-Cr-Mo, titanul pur și Ti-6Al-4V sunt cele mai utilizate . Câteva exemple sunt prezentate în Figura 1.

Figura 1: dispozitive metalice de aplicare medicală: a) cap femural; B) genunchi de articulație superioară; c) Placa articulară mandibulară.
în această lucrare, vom aborda mai specific aliajele Co și Ti, a căror aplicare în prototiparea rapidă DMLS în domeniul medical este mai expresivă.
aliaje de Cobalt
aliaje de Cobalt au fost inițial propuse pentru implanturi chirurgicale mai mult de 70 de ani în urmă . Există practic două tipuri de aliaje de Co pentru aplicații medicale. Aliajul Co-Cr-Mo pentru acoperire și aliajele prelucrate Co-Ni-Cr-Mo . Societatea Americană pentru testare și materiale (ASTM) enumeră patru aliaje de Co care sunt recomandate pentru utilizarea în implanturile chirurgicale: aliaj de acoperire Co-Cr-Mo (F75) și aliaje prelucrate Co-Cr-W-Ni (F90), Co-Ni-Cr-Mo (F562) și Co-Cr-Mo (F1537).
aceste aliaje sunt o clasă de materiale foarte rezistente la coroziune în medii fiziologice și la uzură, depășind oțelul inoxidabil . Mai mult, limita superioară de rezistență și rezistența la oboseală permit aplicarea sa acolo unde este necesară o durată lungă de viață fără apariția fracturilor sau a stresului/oboselii . Multe proprietăți provin din natura cristalografică a cobaltului, efectul de rapel al Cr și Mo și formarea carburilor de duritate ridicată .
astfel de caracteristici speciale au condus la utilizarea acestor aliaje în diverse aplicații medicale, în special în cele care au ca scop înlocuirea suprafețelor articulare. Proprietățile lor de rezistență la uzură, coroziune și coeficient scăzut de frecare sunt decisive în această alegere.
un exemplu de aplicare este artroplastia totală a șoldului (THA). Sistemele mai noi constau într-o tijă femurală atașată la un cap modular supus coordonării cu componenta acetabulară . Acest sistem este cunoscut sub numele de MoM (metal pe metal) – cu referire la suprafața de contact – și este mai bun decât sistemele MoP (metal pe polietilenă), utilizate în raport cu rata volumetrică de uzură și alți parametri de până acum, așa cum este raportat în . Figura 2 prezintă un exemplu de sisteme mop și mama pentru THA.

Figura 2: în stânga: MoP; în dreapta: Mama.
un alt exemplu de aplicare a aliajelor de Co, la care această lucrare este direct legată, este reconstrucția totală a articulației temporomandibulare. Acest tip de proteză, cunoscut sub numele de proteza Christensen, este utilizat de peste 30 de ani și se caracterizează prin promovarea unei reconstrucții stabile, fiabile și previzibile, oferind reducerea nivelului de durere, îmbunătățirea funcționalității și un grad mai mare de mișcare . Figura 3 ilustrează o proteză temporomandibulară.
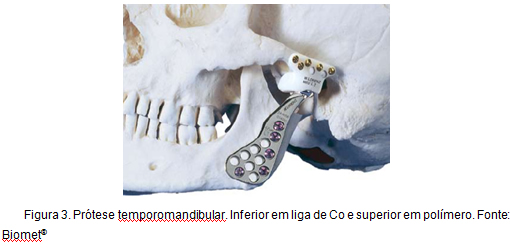
Figura 3: proteză temporomandibulară.
aliaje de titan
descoperit în 1791 de William Gregor, un mineralog Britanic , titanul – și, mai recent, aliajele sale – a fost folosit de zeci de ani în fixarea fracturilor și reconstrucția articulațiilor, deoarece îndeplinește cerințele necesare pentru aplicații biomedicale, cum ar fi: rezistență la uzură, biocompatibilitate, bioadeziune (inducerea creșterii osoase), modul de elasticitate (cu cât este mai aproape de osul uman-10-30 GPa- , cu atât mai bine), rezistență la oboseală și o bună prelucrabilitate , .
Titanul are o structură hexagonală închisă (hcp) legată de faza alfa, care poate suferi o modificare alotropică la 881 CTC pentru structura cubică centrată pe corp (bcc) cunoscută sub numele de faza beta. Manipularea acestor caracteristici cristalografice prin adăugarea de lianți și procese termomecanice permite obținerea aliajelor cu diferite proprietăți.
clasele de titan care au fost introduse inițial ca biomateriale au fost ASTM F67 (titan pur comercial în clasele 1, 2, 3 și 4), ASTM F136 (aliaj Ti-6Al-4V Extra Low interstițial) și ASTM F1472 (aliaj Ti-6Al 4W-standard) . În aceste materiale, unele elemente din aliaj stabilizează faza alfa, în timp ce altele stabilizează faza beta. Se poate stabiliza faza alfa prin includerea aluminiului, staniului și zirconiului, în timp ce faza beta poate fi stabilizată cu vanadiu, molibden, niobiu, crom, fier și mangan . Prin urmare, se remarcă faptul că aliajul ASTM F136 este un exemplu de aliaj alfa/beta stabilizat.
o parte din rezistența la uzură observată în titan și aliajele sale se datorează formării unui strat de oxid pasiv constând în principal din TiO2 care aderă la suprafața metalului și îl protejează, pe lângă faptul că este în mare măsură responsabil pentru biocompatibilitatea materialului. Acest strat poate fi obținut prin oxidare anodică în electrolit de acid acetic și, atunci când se evaluează prezența titanului în țesutul adiacent implantului, acesta este substanțial mai mic în implantul anodizat în comparație cu cei fără anodizare de suprafață , .
trauma severă în structura facială necesită un număr mare de plăci și șuruburi, iar implanturile de titan sunt deosebit de potrivite, datorită proprietăților citate în această revizuire. Există plăci și șuruburi pentru regiunea cranio-maxilo-facială în diferite configurații, astfel încât medicul să poată ajusta sistemul la anatomia pacientului. Figura 4 este un exemplu de aplicare a titanului în fixarea fracturilor cranio-maxilo-faciale.

Figura 4: plăci pentru fixarea fracturilor cranio-maxilo-faciale.
o altă aplicație care demonstrează versatilitatea materialului apare în tijele intramedulare pentru tibia închisă și fractura compusă , unde implantul (Figura 5) este indicat pentru fracturi osoase mai mari și supus unor solicitări mecanice mai mari (tibie).
Figura 5: arborele intramedular Tibial în Ti.
biomateriale ceramice
dezvoltarea materialelor ceramice pentru aplicații biomedicale se concentrează în principal în domeniile ortopediei și stomatologiei . Este o clasă de materiale care include mai multe caracteristici ale biomaterialelor. Are reprezentanți ai claselor bio-inerte, bioresorbabile, bioactive și poroase pentru creșterea țesuturilor .
potențialul ceramicii ca biomateriale provine din asemănarea sa cu mediul fiziologic, datorită constituirii sale de bază a ionilor care se găsesc și în mediul fiziologic (calciu, potasiu, magneziu, sodiu etc.) și altele a căror toxicitate este foarte limitată (zirconiu și titan) .
ceramica bio-inertă este mai reprezentativă în compușii de alumină (Al2O3), zirconiu (ZrO2) și zirconiu stabilizat cu oxid de ytriu (ZrO2 (Y2O3)). Capacitatea lor de a nu reacționa cu țesutul înconjurător, rezistența la coroziune, rezistența ridicată la uzură și rezistența mecanică ridicată sunt caracteristici esențiale în utilizarea lor ca suprafețe articulate supuse sarcinilor și frecării , .
în centrul ceramicii bioactive și bioresorbabile se găsesc compuși cum ar fi hidroxiapatita (HA), fosfații de calciu, în special fosfatul de tricalciu (XV-TCP), precum și bioglasele și ceramica de sticlă, a căror compoziție este compusă dintr-o gamă largă de oxizi (SiO2, P2O5, Cao, CaF2, Na2O, Al2O3, Ta2O5 și TiO2, printre altele.) .
Park, J; Lakes, R. S. „biomaterialele – o introducere”. Springer. 3. un. un.un. un. un. 2007. p. 2.
G Inkticlia, C. A; și colab. „Utilizarea grefei omoloage și heterologe în diafiza femurală a șobolanilor: comparație între grefa osoasă înghețată și liofilizată”. Jurnalul Brazilian de Ortopedie și Traumatologie. Martie 2005.
Marzola, c; Toledo Filho, J. L. „bazele chirurgiei maxilo-faciale orale-implanturi de materiale aloplastice”” Capitolul X.
Pereira, M. M; Buono, V. T. l; Zavaglia, C. A. C. ” Materiale metalice: știință și aplicare ca biomateriale. În: Orefice, R. a; Pereira, M. M; Mansur ,H. S. „biomateriale: fundamente și aplicații”” Rio de Janeiro. Cultura medicală, 2006, cap. 2, p. 39-58.
Bath, S. V. „biomateriale”. Editura Narosa. Nova Dheli, India. 2002. p. 181
Santos, L. A. ” dezvoltarea fosfatului de calciu refor inktifado por fibras para uso na intrea m inktdico-odontol inktgica.”Tese de Doutorado. Universitatea de Stat din Campinas. 2002.
Wong, J. Y; Bronzinho, J. D. „biomateriale”. Grupul Taylor și Francis. LLC. 2007. p. 1-1.
Barbucci, R. „știința Biomaterială integrată”. Kluwer Academic / Plenum Publishers. New York.2002. cap.6. p. 289-290.
Bertol, L. S. „Contribuția la studiul prototipării rapide, digitalizării tridimensionale și selecției materialelor în proiectarea implanturilor personalizate”” disertația maestrului. Universitatea Federală din Rio Grande do Sul. Porto Alegre. 2008.
Donachie M. „Metals Handbook desk Edition”. Ediția a 2-a, editată de Davis, J. R. ASM International. 1998.
Disegi, J. A; Kennedy, R. L; Pilliar, R. „aliaje pe bază de Cobalt pentru aplicații biomedicale”. ASTM-STP 1365. 1999.
Shi, D. „Introducere în biomateriale”. Tsinghua University Press, Lumea Științifică. 2006. p-123.
Marti, A. „aliaje de Cobalt-bază utilizate în chirurgia osoasă”. Prejudiciu-Jurnalul Internațional al îngrijirii răniților. 2000 (31).
Wnek, G. E; Bowlin, G. L. „enciclopedia biomaterialelor și ingineriei biomedicale”. Vol. 2. 2. unt. unt.unt. unt. Informa Healthcare. 2008.
Sieber, H. P; Rieker, C. B; K Inkttig, P. „analiza a 118 implanturi de șold recuperate din metal pe metal de a doua generație”. Jurnalul de os & Chirurgie articulară (Br). 1998; 80-B: 46-50.
Garret, W. R; Abbey, P. A; Christensen, R. „Reconstrucția articulației temporomandibulare cu o proteză articulară temporomandibulară totală personalizată: utilizare la pacientul operat multiplu”. O retipărire de la Surgical Technology International VI.
Leyens, c; Manfred, P. „Titan și aliaje de titan: fundamente și aplicații”. Wiley-VCH. Prima ediție. 2003. p-1.
Yaszemski, M. J; Tantrolo, D. J; Lewandrowski, K; Hasirci, V; Altobelli, D. E; Wise, D. L. „biomateriale în ortopedie”. Marcel Dekker Inc. 2004. p-2.
L Xvtjering, G; Williams, J. C. „titan – materiale și procese de inginerie. Springer-Verlag. Ediția a doua. 2003. p-399.
Brown, S. A; lămâi, J. E. „aplicații medicale ale titanului și aliajelor sale: problemele materiale și biologice”. Lucrările unui simpozion organizat în 1994 în Phoenix, Arizona. STP 1272. ASTM. 1996.
Bruneta, D. M; Tengvall, P; Textor, m; Thomsen, P. „Titan în medicină: știința materialelor, știința suprafeței, inginerie, răspunsuri biologice și aplicații medicale”. Springer-Verlag. 2001. p-28.
Larsson, c; Thomsen, P; Aronsson, B. O; Rodahl, M; Lausmaa, J; Kasemo, B; Ericson, L. E. „Răspunsul osos la implanturile de titan modificate la suprafață: studii privind răspunsul timpuriu al țesutului la implanturile prelucrate și electropolizate cu diferite grosimi de oxid”. Biomaterias 17 (1996) 605-616. Elsevier .
Jorgenson D. S; Centeno, J. A; Mayer M. H; Topper, M. J; Nossov, P. C; Mullick, F. G; Manson, P. N. „răspuns Biologic la dizolvarea pasivă a microplăcilor craniofaciale de titan”. Biomateriale 20 (1999) 675-682. Elsevier.
Zimmer Sirus – sistem de unghii intramedular. Zimmer, 2007.
Shakelford, J. F. „bioceramică – ceramică avansată; v. 1”. Gordon și Breach Science Publishers, 1999. p-5.
Hench, L. L. „bioceramica: de la concept la clinică”. J. Am. Ceram. Soc., 74 (7) 1487-510 (1991).Hench, L. L; Wilson, J. „O introducere în bioceramică”. World Scientific Publishing Co, 1993. p-25.
Bubok, V. A. „bioceramica – Ieri, Azi, Mâine”. Metalurgia pulberilor și ceramica metalică, Vol. 39, nr. 7-8, 2000.
proteze personalizabile
reconstrucție Cranio-maxilo-facială prin prototipare rapidă
prototiparea rapidă este tehnica de fabricare a pieselor prin metoda aditivă. Un model 3D creat într-un sistem CAD este secționat în profiluri 2D care sunt apoi construite prin echipamente de prototipare rapidă strat cu strat. Mai multe tehnici sunt disponibile astăzi, cum ar fi: stereolitografia (SLA), sinterizarea directă cu laser a metalelor (DMLS), topirea suprafeței Laser (LSM), modelarea depunerii topite (FDM), imprimarea 3d (3DP) și sudarea cu fascicul de electroni (EBW) .
în primul deceniu de utilizare a tehnicii DMLS, din 1994 până în 2004, a fost dominat, cel puțin în aplicațiile sale comerciale, de materiale dezvoltate special pentru procesul DMLS, și anume cu accent pe îmbunătățiri ale procesabilității și proprietăților acceptabile pentru cele mai frecvente aplicații. În zilele noastre, o gamă largă de aliaje este disponibilă pentru utilizare în DML-uri, cum ar fi aliajele ușoare de titan. De interes special în domeniul medical sunt Ti-6Al-4V – titan, aluminiu, vanadiu și Ticp – titan pur comercial. Ambele se caracterizează prin proprietățile mecanice excelente, rezistența la coroziune, greutatea specifică redusă și, în special, prin biocompatibilitatea sa .
în mod tradițional, prototiparea rapidă (RP) este utilizată în industrie și inginerie ca mijloc de a produce prototipuri fiabile într-un timp scurt, ceea ce aduce câștiguri în costuri . Recent, RP și-a extins aplicația dincolo de produsele de inginerie. Utilizarea sa în domeniul medical la fabricarea implanturilor și protezelor personalizate, studiul anatomiei și planificarea chirurgicală includ domenii importante de cercetare . Apelul privind domeniul medical se confruntă cu obstacole semnificative, cum ar fi faptul că un caz nu este niciodată egal unul cu celălalt – motiv pentru care standardizarea în producția de implanturi nu este avantajoasă – și problemele legate de punctele obscure ale regiunii chirurgiei îngreunează planificarea chirurgicală .
printre defectele congenitale, anomaliile craniofaciale (CFA) sunt un grup extrem de divers și complex care afectează o proporție semnificativă de oameni din lume .
pe lângă cazurile de deformări congenitale, există defecte craniofaciale dobândite din cauza altor tulburări – tumori, de exemplu. În ultimele patru decenii, a fost observat și un volum tot mai mare de cazuri de traume faciale, care este strâns legat de creșterea accidentelor auto și a violenței urbane.
în toate cazurile, reabilitarea cranio-maxilo-facială face parte din procesul de reintegrare a pacienților în societate și promovarea bunăstării.
prototipuri rapide în reconstrucția craniului și feței
mijloacele convenționale de fabricare a unui implant pentru repararea defectului cranian constau în modelarea directă a implantului în locul chirurgical în timpul intervenției chirurgicale. Imprimarea se face în ceară și ulterior utilizată la fabricarea unei matrițe biomateriale . La sfârșitul anilor 1980, au apărut rezultatele primelor cercetări care au încercat să găsească o modalitate de a produce un model fizic direct dintr-un model digital tridimensional .
prototiparea rapidă este o metodă de fabricație strat cu strat care poate produce geometrie complexă dintr-un model CAD .
utilizarea sa în aplicații medicale a revoluționat planificarea intervențiilor chirurgicale complexe prin construirea de modele anatomice preoperatorii care permit personalului medical să aibă o evaluare critică a fiecărui caz particular . De asemenea, a primit un mare accent pe utilizarea sa în fabricarea personalizată a implanturilor pentru reconstrucția craniului și a defectelor faciale , , , , .
în construcția implanturilor personalizate, este necesară introducerea datelor pacienților. Datele sunt obținute de la CT sau NMRI în felii transversale 2D în format DICOM, a căror grosime este determinată pe echipament la obținerea imaginilor. Numărul de felii este ceea ce determină rezoluția imaginii și, prin urmare, modelul 3d. Feliile 2D sunt transferate pe software-ul de modelare medicală unde este posibilă ajustarea semnalului de prag pentru a obține, după interpolare, o reprezentare 3D a structurii osoase , .
după obținerea modelului, acesta poate fi manipulat în software CAD pentru modelarea implantului care va repara defectul osos.
solidul modelat este apoi transformat în format STL și poate fi prototipat prin orice tehnici de prototipare rapidă.
aplicații recente, materiale și rapoarte de caz
în zona de reparații cranio-maxilo-facială, au fost raportate mai multe cazuri de aplicare cu succes a tehnologiilor de modelare 3D și prototipuri rapide pentru a avea implanturi personalizate.
Bertol și colab. a raportat utilizarea imaginilor tomografice în obținerea unui model virtual 3D pentru procedura de rezecție virtuală a unei părți a maxilarului afectat de o tumoare și proiectarea ulterioară a implantului pentru a înlocui regiunea afectată prin tehnica oglindirii prin planul de simetrie, unde porțiunea sănătoasă a maxilarului este oglindită și utilizată în reconstrucția regiunii îndepărtate.
Figura 7: procesul de obținere a modelului 3D și a implantului (în stânga). Implant construit de DMLS (pe dreapta) .
implantul a fost construit din titan (Ti-6Al-4V) prin utilizarea tehnicii de sinterizare cu laser cu Metal direct (DMLS). În acest proces, metalul sub formă de pulbere este topit într-o parte solidă prin topirea locală asigurată de un fascicul laser de energie ridicată direcționat de computer în funcție de proiectarea piesei.
după fabricarea implantului, acesta a fost scanat prin tehnica de scanare 3D pentru compararea dimensională cu modelul virtual. Diferențele nu au fost mai mari de 0,05 mm, ceea ce demonstrează acuratețea metodei.
Drstvensek și colab au raportat, de asemenea, cazuri de succes care demonstrează marele potențial al prototipurilor rapide în domeniul medical. Într-un caz raportat, a fost tratată o asimetrie facială severă (microsomie hemifacială). Metodologia utilizată a fost similară cu cea utilizată de Bertol și colab. Modelele 3D au fost obținute din imagini CT și implantul a fost dezvoltat în mediu virtual prin oglindirea părții neafectate.
figura 8: modelul Virtual al zonei de construit (în stânga); Implant fabricat de DMLS .
într-un alt caz raportat de Drstvensek și colab , au fost utilizate aceleași tehnici în fabricarea unui implant de craniu și scanarea 3D posterioară pentru controlul dimensional. În comparație cu modelul virtual, implantul a prezentat variații de 0,8 până la 1,0 mm în unele regiuni. Potrivit autorului, datorită faptului că regiunea în cauză nu este situată într-o parte critică, implantul a fost aprobat și implementat cu succes. Tehnica de prototipare utilizată în ambele cazuri a fost DMLS, iar materialul a fost Ti-6Al-4V.
Figura 9: Proteză fabricată de DMLS (în stânga). Rezultatul inspecției geometrice virtuale (în dreapta).
recent, mai multe studii s-au concentrat asupra asocierii proprietăților în fabricarea implanturilor. Acest lucru se întâmplă, de exemplu, în combinația proprietăților de rezistență mecanică și coroziunea titanului cu bioactivitatea ceramicii, cum ar fi HA și XV-TCP.
Ning și Zhou , au evaluat bioactivitatea in vitro și in vivo a biocompozitelor fabricate din pulberi HA și Ti prin metoda metalurgică a pulberilor. Amestecurile in proportii diferite de HA / Ti au fost amestecate si sintetizate la 1200% C. rezultatele arata ca compozitele cu cel mai mare continut de Ti au capacitatea de a induce nucleația si cresterea apatitei pe suprafata lor, care asigura cresterea osoasa si fac biocompozitele metal/ceramice candidate pentru inlocuirea osoasa.
Kim și colab au depus pelicule dense și uniforme de HA și FHA (hidroxiapatită-fluoro) cu grosimea ~ 5 centimm în substraturi de titan folosind tehnica sol-gel. Substratul a prezentat o creștere favorabilă și proliferarea osteoblastelor, crescând activitatea și funcția substratului.
de-a lungul aceleiași linii de lucru, Bertol a raportat două cazuri cu asocierea Ti și TCP-TCP. Un implant personalizat a fost obținut prin turnare manuală pe modelul fizic al pacientului obținut din imagini tomografice (podea orbitală), în timp ce celălalt a fost prelucrat conform designului virtual obținut și din imagini tomografice (mandibulă). În ambele cazuri, implanturile au fost acoperite cu TCP și au fost implementate cu succes.
Figura 10:
nu numai titanul, ci și aliajele de Co au folosit compozite ceramice pentru a-și îmbunătăți unele proprietăți. Yen și colab raportează acoperirea electrolitică a unui aliaj Co-Cr-Mo cu ZrO2 la o proteză de șold. În acest caz, aplicarea stratului de acoperire a redus uzura componentei metalice față de componenta polimerică și a scăzut coeficientul de frecare dintre suprafețe.
Khan, S. F.; Dalgarno K. W. „Proiectarea implanturilor medicale personalizate prin fabricație stratificată”. Școala de inginerie mecanică și sisteme. Universitatea NC-MAREA BRITANIE.
Ma, D; Lin F; Chua C. K. „aplicații rapide de prototipare în medicină. Partea 1: modelarea volumului bazată pe NURBS”. Jurnalul Internațional de tehnologie avansată de fabricație. Springer-Verlag Londra Limited. 2001
Lima, B. C. „Engenharia Reversa e Prototipagem R Colospida: Estudo de Casos”. pp 15-16. 2003.
Shellabear, M; Nyrhil, O. „DMLS – istoria dezvoltării și stadiul tehnicii”. LANE, Erlanger. 2004.
Shellabear, M; Nyrhil XV, O. „progrese în materialele și proprietățile pieselor metalice directe sinterizate cu Laser”. LANE, Erlanger. 2004.
Molle XV, I. L. „anomalii craniofaciale, genetică și Sănătate Publică: contribuții la recunoașterea situației actuale a îngrijirii în sistemul unificat de sănătate”” Unicamp. 2004.
Lima Silva, J. J. de; Lima, A. A. A. S.; Torres ,S. M. „fracturi de față: analiza a 105 cazuri”” Revista Brasileira de Cirurgia Craniomaxilofacial / Asociația braziliană de Chirurgie Cranio-Maxilo-Facială. – Vol.12, Nr. 1 (Jan.2009).
Gopakumar, S. ” RP în medicină: un studiu de caz în chirurgia reconstructivă craniană”” Rapid Prototyping Journal. Volumul 10 * numărul 3 * 2004 * pp.207-211.
Bertol, L. S. „contribuția la studiul prototipurilor rapide, digitalizarea tridimensională și selecția materialelor în proiectarea implanturilor personalizate”” disertația maestrului. Universitatea Federală din Rio Grande do Sul. Porto Alegre. 2008.
Naber, H. „progrese în tehnologiile de prototipare rapidă”, Conferința de materiale și producție, Metalex, Thailanda. 1998.
Gibson, eu; Cheung, L. K; Chow, S. p; Cheung, W. l; Ei bine, S. L; Savalani, m; Lee, S. H. „utilizarea prototipurilor rapide pentru a ajuta aplicațiile medicale”. Jurnalul De Prototipuri Rapide 12/1 (2006) 53-58.
Hench, L. L. „bioceramica: de la concept la clinică”. J. Am. Ceram. Soc., 74 (7) 1487-510 (1991).
Wu, W; Shang, Y; Li, h; Wang, W. „fabricarea reparării defectelor osoase ale craniului pe baza prototipurilor rapide”. Jurnalul de polimeri bioactivi și compatibili, Vol. 24-Mai 2009.
Bertol, L. s; Junior, W. K; Silva, F. P. d. ; Aumund-Kopp, C. „Design Medical: sinterizarea directă cu laser a metalelor Ti-6Al-4V”. Materiale și Design (2010), doi: 10.1016/j.matdes.2010.02.050.
Oliveira, R. S. d; Brigato, R; Madureira, J. F. G; Cruz, A. A. V; Filho, F. V. d. M; Alonso, n; Machado, H. R. „reconstrucția unui defect mare de craniu complex la un copil: un raport de caz și o revizuire a literaturii”. Childs Nerv Syst (2007) 23:1097-1102.
Drstvensek, I; Hren, N. I; Strojnik, T; Brajlih, t; Valentan, B; Pogacar, V; Hartner, T. Z. „aplicații ale prototipurilor rapide în procedurile de Chirurgie Cranio-Maxilo-Facială”. Jurnalul Internacional de Biologie și Inginerie Biomedicală. Numărul 1, Volumul 2, 2008.
Ning, C. Q; Zhou, Y. „bioactivitatea in vitro a unui biocompozit fabricat din pulberi HA și Ti prin metoda metalurgiei pulberilor. Biomateriale 23 (2002) 2909-2915.
Ning, C. Q; Zhou, Y. „corelații între bioactivitatea in vitro și in vivo a compozitelor Ti / HA fabricate prin metoda metalurgiei pulberilor”. Acta Biomaterialia 4 (2008) 1944-1952.