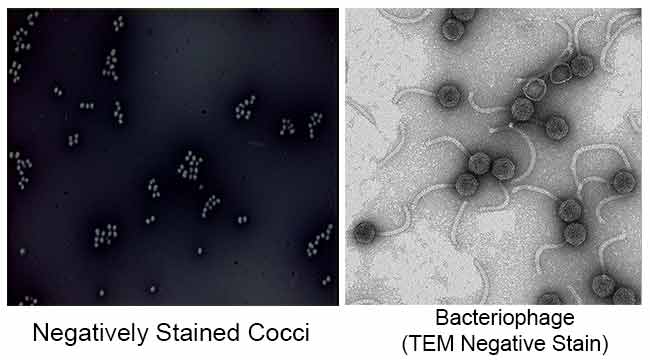
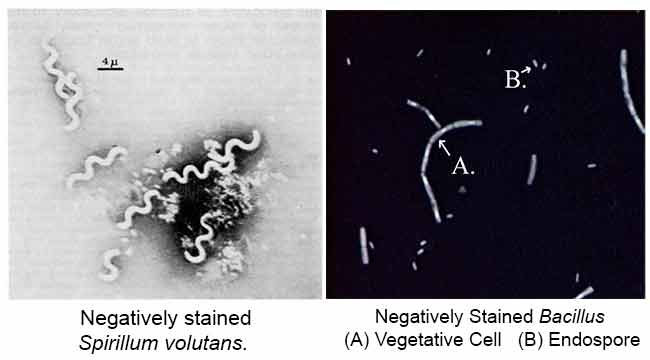
scopul principal al colorării Negative este de a studia forma morfologică, dimensiunea și dispunerea celulelor bacteriene dificil de colorat. de exemplu: Spirilla. Poate fi folosit și pentru a colora celulele prea delicate pentru a fi fixate la căldură.
este, de asemenea, utilizat pentru a pregăti probe biologice pentru microscopie electronică. Este folosit pentru a vizualiza viruși, bacterii, flageli bacterieni, structuri de membrană biologică și proteine sau agregate proteice, care toate au o putere scăzută de împrăștiere a electronilor. Este, de asemenea, utilizat pentru studiul și identificarea agregatelor lipidice apoase, cum ar fi lipozomii lamelari (le), micelele sferice inversate (M) și fazele cilindrice hii hexagonale inversate (H) prin microscopie electronică de transmisie prin colorare negativă.
principiul colorării Negative
colorarea negativă necesită un colorant acid, cum ar fi cerneala din India sau Nigrosina.
cerneala din India sau Nigrosina este o pată acidă. Aceasta înseamnă că pata renunță cu ușurință la un ion de hidrogen (proton) și cromoforul colorantului devine încărcat negativ. Deoarece suprafața majorității celulelor bacteriene este încărcată negativ, suprafața celulară respinge pata. Paharul diapozitivului va pata, dar celulele bacteriene nu vor. Bacteriile vor apărea ca pete clare pe un fundal întunecat.
reactivi de colorare negativă
cerneală India
Nigrosin
Nigrosin 100 gm/L, formalină 5 ml/l în apă
procedura de colorare negativă
1. Plasați o picătură foarte mică (mai mult decât o buclă plină, mai puțin decât o picătură liberă din picurător) de nigrosin lângă un capăt al unui diapozitiv bine curățat și flambat.
2. Îndepărtați o cantitate mică de cultură din înclinare cu o buclă de inoculare și dispersați-o în picătura de pată fără a răspândi picătura.

3. Folosiți un alt diapozitiv curat pentru a răspândi picătura de pată care conține organismul folosind următoarea tehnică.

4. Așezați un capăt al diapozitivului curat pe centrul diapozitivului cu pata. Înclinați diapozitivul curat spre picătură formând un unghi ascuțit și trageți acel diapozitiv spre picătură până când atinge picătura și o face să se răspândească de-a lungul marginii diapozitivului de împrăștiere. Menținând un unghi ascuțit mic între lamele, împingeți diapozitivul distribuitorului spre capătul curat al diapozitivului fiind pătat trăgând picătura în spatele diapozitivului distribuitorului și producând un frotiu larg, uniform, subțire.
 |
 |
5. Lăsați frotiul să se usuce fără încălzire.

6. Concentrați o zonă subțire sub imersiune în ulei și observați celulele nepătate înconjurate de pata gri.
procedura de vizualizare în microscopul electronic de transmisie (TEM)
- țineți o grilă acoperită cu fața în sus într-o pereche de forceps de auto-strângere.
- faceți un amestec 1: 1 de probă și pată negativă (de ex. 2% acetat de uranil sau 2% fosfotungstat de sodiu sau potasiu, pH 7,4). Adăugați 5 unqql la grilă. Particulele mai mici se adsorb la suprafața rețelei mai rapid decât particulele mai mari.alternativ, proba amestecată cu fixativ poate fi adăugată la grilă înainte de colorarea negativă ulterioară.
- incubați timp de 30-90 de secunde, apoi îndepărtați excesul de lichid cu marginea ruptă a unei bucăți de hârtie de filtru.
- se usucă la aer și se examinează în TEM.
rezultatele colorării Negative