Generic Name: epinastine hydrochloride
Dosage Form: ophthalmic solution
Medically reviewed by Drugs.com. Last updated on June 1, 2020.
- Overview
- Side Effects
- Dosage
- Professional
- Pregnancy
- More
Indications and Usage for Epinastine HCl Ophthalmic Solution
Epinastine HCl Ophthalmic Solution 0.05% este indicat pentru prevenirea mâncărimii asociate cu conjunctivita alergică.
Epinastină HCl Soluție oftalmică dozare și Administrare
doza recomandată este de o picătură în fiecare ochi de două ori pe zi.
tratamentul trebuie continuat pe toată perioada de expunere (adică până la terminarea sezonului de polen sau până la încetarea expunerii la alergenul ofensator), chiar și atunci când simptomele sunt absente.
forme de dozare și concentrații
soluție care conține 0.5 mg / mL Epinastină HCl
contraindicații
nici unul
Atenționări și precauții
contaminarea vârfului și soluției
pacienții trebuie instruiți să evite contactul vârfului recipientului de dozare cu ochiul, structurile înconjurătoare, degetele sau orice altă suprafață pentru a evita contaminarea soluției cu bacterii comune cunoscute a provoca infecții oculare. Deteriorarea gravă a ochiului și pierderea ulterioară a vederii pot rezulta din utilizarea soluțiilor contaminate.
flaconul trebuie ținut bine închis atunci când nu este utilizat.
utilizarea cu lentile de Contact
pacienții trebuie sfătuiți să nu poarte lentile de contact dacă ochii lor sunt roșii. Epinastina HCl Soluție oftalmică 0, 05% nu trebuie utilizată pentru a trata iritarea legată de lentilele de contact.
conservantul din soluția oftalmică Epinastină HCl 0,05%, clorura de benzalconiu, poate fi absorbit de lentilele de contact moi. Lentilele de Contact trebuie îndepărtate înainte de instilarea Epinastinei HCl Soluție oftalmică 0,05% și pot fi reintroduse după 10 minute de la administrare.
numai pentru uz oftalmic topic
Epinastină HCl Soluție oftalmică 0.05% este numai pentru uz oftalmic topic și nu pentru injectare sau utilizare orală.
reacții Adverse
studii clinice experiență
deoarece studiile clinice sunt efectuate în condiții foarte variate, ratele reacțiilor adverse observate în studiile clinice ale unui medicament nu pot fi comparate direct cu ratele din studiile clinice ale unui alt medicament și pot să nu reflecte ratele observate în practică.
reacțiile adverse oculare raportate cel mai frecvent la aproximativ 1-10% dintre pacienți au fost senzația de arsură la nivelul ochiului, foliculoza, hiperemia și pruritul.
reacțiile adverse non-oculare cel mai frecvent raportate au fost infecții (simptome de răceală și infecții ale căilor respiratorii superioare), observate la aproximativ 10% dintre pacienți, și cefalee, rinită, sinuzită, tuse crescută și faringită, observate la aproximativ 1 – 3% dintre pacienți.
unele dintre aceste reacții au fost similare cu boala de bază studiată.
experiența după punerea pe piață
următoarele reacții au fost identificate în timpul utilizării Epinastinei HCl Soluție oftalmică 0,05% după punerea pe piață în practica clinică. Deoarece sunt raportate voluntar de la o populație de dimensiuni necunoscute, nu se pot face estimări ale frecvenței. Reacțiile, care au fost alese pentru includere fie datorită gravității, frecvenței raportării, posibilei legături cauzale cu soluția oftalmică Epinastină HCl 0, 05%, fie a unei combinații a acestor factori, includ: lăcrimare crescută.
utilizare la populații specifice
sarcina
efecte teratogene
sarcina categoria C
într-un studiu de dezvoltare embriofetală la șobolani gestanți, toxicitatea maternă fără efecte embriofetale a fost observată la o doză orală de aproximativ 150000 de ori doza maximă recomandată la om (MROHD) de 0, 0014 mg/kg și zi, raportat la mg/kg. Resorbțiile totale și avortul au fost observate într-un studiu embriofetal la iepuri gestante, la o doză orală de aproximativ 55 000 de ori mai mare decât MROHD. În ambele studii, nu s-au observat efecte teratogene induse de medicamente.
Epinastina a redus creșterea în greutate a puilor după administrarea unei doze orale la șobolanii gestanți, care a fost de aproximativ 90 000 de ori mai mare decât MROHD.
cu toate acestea, nu există studii adecvate și bine controlate la femeile gravide. Deoarece studiile de reproducere la animale nu sunt întotdeauna predictive pentru răspunsul uman, soluția oftalmică Epinastină HCl 0, 05% trebuie utilizată în timpul sarcinii numai dacă beneficiul potențial justifică riscul potențial pentru făt.
mamele care alăptează
Un studiu la șobolani care alăptează a evidențiat excreția epinastinei în laptele matern. Nu se știe dacă acest medicament este excretat în laptele uman. Deoarece multe medicamente sunt excretate în laptele uman, trebuie să aveți precauție atunci când soluția oftalmică Epinastină HCl 0,05% este administrată unei femei care alăptează.
utilizare pediatrică
siguranța și eficacitatea la pacienții pediatri cu vârsta sub 2 ani nu au fost stabilite.
utilizare geriatrică
nu s-au observat diferențe globale de siguranță sau eficacitate între pacienții vârstnici și cei mai tineri.
Epinastină HCl Soluție oftalmică descriere
Epinastină HCl Soluție oftalmică 0.05% is a clear, colorless, sterile isotonic solution containing epinastine HCl, an antihistamine and an inhibitor of histamine release from the mast cell for topical administration to the eyes.
Epinastine HCl is represented by the following structural formula:
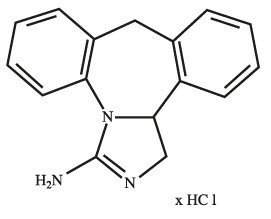
C16H15N3HCl Mol. Wt. 285.78
Chemical Name:
3-Amino-9,13b-dihydro-1H-dibenzimidazoazepine hydrochloride
Each mL contains: Active: Epinastine HCl 0.05% (0.5 mg/mL) equivalent to epinastine 0.044% (0.44 mg/mL); Preservative: Benzalkonium chloride 0.01%; Inactives: Edetat disodic, dihidrat; apă purificată; clorură de sodiu; fosfat de sodiu, monobazic, anhidru; și hidroxid de sodiu și/sau acid clorhidric (pentru ajustarea pH-ului).
Epinastina HCl Soluție oftalmică 0,05% are un pH de aproximativ 7 și un interval de osmolalitate de 250 până la 310 mOsm / kg.
Soluție oftalmică Epinastină HCl – Farmacologie Clinică
mecanism de acțiune
Epinastina este un antagonist activ local, direct al receptorilor H1 și un inhibitor al eliberării histaminei din celulele mastocite. Epinastina este selectivă pentru receptorul histaminic H1 și are afinitate pentru receptorul histaminic H2. Epinastine, de asemenea, posedă afinitate pentru α1, α2-, și 5-HT2–receptori.
farmacocinetica
paisprezece subiecți, cu conjunctivită alergică, au primit o picătură de soluție oftalmică Epinastină HCl 0,05% în fiecare ochi de două ori pe zi timp de 7 zile. În ziua 7, concentrațiile plasmatice maxime medii ale epinastinei de 0,04 0,014 ng/ml au fost atinse după aproximativ două ore, indicând o expunere sistemică scăzută. În timp ce aceste concentrații au reprezentat o creștere față de cele observate după o singură doză, valorile ariei de sub curbă (ASC) din ziua 1 și ziua 7 au rămas neschimbate, indicând faptul că nu există o creștere a absorbției sistemice cu doze multiple. Epinastina se leagă în proporție de 64% de proteinele plasmatice. Clearance-ul sistemic total este de aproximativ 56 L/oră, iar timpul de înjumătățire plasmatică prin eliminare este de aproximativ 12 ore. Epinastina este excretată în principal nemodificată. Aproximativ 55% dintr-o doză intravenoasă este recuperată neschimbată în urină, cu aproximativ 30% în fecale. Mai puțin de 10% este metabolizat. Eliminarea renală se realizează în principal prin secreție tubulară activă.
Toxicologie non-clinică
carcinogeneză, mutageneză, afectarea fertilității
în studiile de carcinogenitate alimentară cu durata de 18 luni sau 2 ani la șoareci sau șobolani, epinastina nu a fost carcinogenă la doze de până la 40 mg / kg .
Epinastina în loturile nou sintetizate a fost negativă pentru mutagenitate în testul Ames / Salmonella și testul aberației cromozomiale in vitro utilizând limfocite umane. Rezultate pozitive au fost observate la loturile timpurii de epinastină în două studii in vitro privind aberațiile cromozomiale efectuate în anii 1980 cu limfocite periferice umane și, respectiv, cu celule V79. Epinastina a fost negativă în studiile de clastogenitate in vivo, incluzând testul micronucleilor de șoarece și testul aberațiilor cromozomiale la hamsterii chinezi. Epinastina a fost, de asemenea, negativă în testul de transformare celulară utilizând celule embrionare de hamster sirian, testul de mutație punctuală a celulelor de mamifere V79/HGPRT și testul de sinteză ADN neprogramat in vivo/in vitro utilizând hepatocite primare de șobolan.Epinastina nu a avut niciun efect asupra fertilității șobolanilor masculi. Scăderea fertilității la femelele de șobolan a fost observată la o doză orală de până la aproximativ 90 000 de ori mai mare decât MROHD.
studii clinice
Epinastina HCl 0,05% s-a dovedit a fi semnificativ superioară vehiculului pentru ameliorarea pruritului ocular la pacienții cu conjunctivită alergică în studiile clinice care au utilizat două modele diferite: (1) provocarea antigenului conjunctival (CAC) în care pacienților li s-a administrat doze și apoi li s-a administrat antigen instilat în fornixul conjunctival inferior; și (2) studii de teren de mediu în care pacienții au fost dozați și evaluați în timpul sezonului de alergie în habitatul lor natural. Rezultatele au demonstrat un debut rapid al acțiunii pentru Epinastină HCl 0,05% în decurs de 3 până la 5 minute după provocarea antigenului conjunctival. Durata efectului s-a dovedit a fi de 8 ore, ceea ce face adecvat un regim de două ori pe zi. Acest regim de dozare s-a dovedit a fi sigur și eficient timp de până la 8 săptămâni, fără dovezi de tahifilaxie.
cum furnizate/depozitare și manipulare
Epinastină HCl Soluție oftalmică 0.05% este furnizat steril în sticle opace din plastic alb LDPE cu vârfuri de picurător și capace albe din polipropilenă (PP) după cum urmează:
| 5 mL în flacon de 10 mL | NDC 51991-836-75 |
depozitare: a se păstra la numărul 20 – 25 – C (68-77-F) . A se păstra flaconul bine închis și la îndemâna copiilor.
informații de consiliere a pacientului
sterilitatea vârfului picurătorului
pacienții trebuie sfătuiți să nu atingă vârful picurătorului pe nicio suprafață, deoarece acest lucru poate contamina conținutul (vezi avertismente și precauții, 5.1).
utilizarea concomitentă a lentilelor de Contact
pacienții trebuie sfătuiți să nu poarte lentile de contact dacă ochii lor sunt roșii. Pacienții trebuie avertizați că Epinastina HCl Soluție oftalmică 0,05% nu trebuie utilizată pentru a trata iritația asociată lentilelor de contact. De asemenea, pacienții trebuie sfătuiți să îndepărteze lentilele de contact înainte de instilarea soluției oftalmice Epinastină HCl 0,05%.
conservantul din soluția oftalmică Epinastină HCl 0,05%, clorura de benzalconiu, poate fi absorbit de lentilele de contact moi. Lentilele pot fi reintroduse după 10 minute de la administrarea Epinastinei HCl Soluție oftalmică 0,05%
numai pentru administrare oftalmică topică
numai pentru administrare oftalmică topică.
Rx numai
distribuit de:
Breckenridge Pharmaceutical, Inc.
Berlin, CT 06037
fabricat de:
PrimaPharma, Inc.
San Diego, CA 92121
Rev: 04/2020
2323 04/20
PRINCIPAL DISPLAY PANEL – 5 mL Bottle Carton
NDC 51991-836-75
Epinastine HCl
Ophthalmic
Solution,
0.05%
FOR USE IN THE
EYES ONLY
sterile
Rx Only
5 mL sterile
breckenridge
A Towa
Company

| EPINASTINE HYDROCHLORIDE epinastine hydrochloride solution/ drops |
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
Labeler – Breckenridge Pharmaceutical, Inc. (150554335)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| PrimaPharma, Inc. | 079699106 | MANUFACTURE(51991-836) | |
mai multe despre epinastină oftalmică
- efecte secundare
- în timpul sarcinii sau alăptării
- informații despre dozare
- prețuri & cupoane
- în engleză
- 3 recenzii
- clasa de droguri: antihistaminice și decongestionante oftalmice
resurse pentru consumatori
- informații pentru pacienți
- Epinastină oftalmică (citire avansată)
resurse profesionale
- informații de prescriere
- Epinastină (sfaturi profesionale pentru pacienți)
Alte mărci elestat
ghiduri de tratament conexe
- conjunctivită, alergică
Disclaimer medical