John E. Cunningham
EINFÜHRUNG
Pseudarthrose oder Non-Union ist eine allzu häufige und teure Komplikation der Wirbelsäulenfusionschirurgie, wobei die Kosten pro gewonnenem QALY (Quality-adjusted life year) auf etwa 118.945 US-Dollar geschätzt werden.1 Die Schätzungen der Raten variieren stark zwischen Studien, die verschiedene chirurgische Techniken verwenden und Patientenpopulationen.2
Pseudarthrose wird normalerweise als Versagen der knöchernen Vereinigung zwischen zwei Wirbeln innerhalb von 12 Monaten nach der Operation definiert.3 Bis eine solide Knochenfusion erreicht ist, sollte der Chirurg unabhängig von der anfänglichen Indikation für die Fusionsoperation nicht berücksichtigen, dass sein Patient einen chirurgischen Endpunkt erreicht hat.
Prävention von Pseudarthrose kann schwierig sein, ebenso wie Diagnose und Behandlung. Ein Teil der Schwierigkeit der Prävention können die Risikofaktoren des Patienten sein, die kurzfristig oft nicht veränderbar sind. Chirurgen werden ermutigt, diese Risikofaktoren zur Kenntnis zu nehmen und ihre chirurgische Behandlung zu ändern, um diese Risiken so gut wie möglich zu verbessern. Gelegentlich kann dies die Verzögerung oder sogar den Abbruch eines chirurgischen Eingriffs umfassen, wenn das Risiko einer Pseudarthrose und das daraus resultierende schlechte Ergebnis den voraussichtlichen Nutzen einer Operation überwiegen.
Die Darstellung der Pseudarthrose umfasst meistens Schmerzen, die in der Regel zentral sind und deren Beginn viele Monate nach der Operation auftreten kann. Die Untersuchung und Diagnose umfasst am häufigsten eine fein geschnittene CT-Untersuchung, und die Berücksichtigung einer begleitenden Infektion sollte immer einbezogen werden. Die Behandlung beinhaltet meistens eine Revisionsoperation mit einer Vielzahl von Techniken.
RISIKOFAKTOREN
Patientenfaktoren spielen eine bedeutende Rolle im Hinblick auf das Pseudarthrose-Risiko. Rauchen ist einer der besser untersuchten Risikofaktoren.4,5 Brown et al., führte eine randomisierte Studie an 100 Patienten durch, die sich einer zweistufigen uninstrumentierten Fusion von L4 zum Kreuzbein unterzogen.6 Die Nichtraucher hatten eine Pseudarthroserate von 8%, während normale Raucher mit 40% eine fünfmal höhere Rate aufwiesen. Eine neuere Studie untersuchte die Auswirkungen des Rauchens in Gegenwart von Pedikelschrauben-Instrumenten, jedoch ohne Interbody-Geräte.7 Bei einstufigen Fusionen fanden sie keinen Unterschied in den Fusionsraten, aber bei zweistufigen Fusionen war die Pseudarthrose dreimal höher (29% gegenüber 11%).
Andere Patientenfaktoren, die die Gewerkschaftsrate beeinflussen, sollten einen Orthopäden nicht überraschen, da sie denen für allgemeine Nicht-Gewerkschaften ähneln. Dazu gehören Alter, die Verwendung von Steroiden und NSAIDS, Diabetes, Unterernährung und vorherige Operation.8,9 Die perioperative Bestrahlung verringert auch die Fusionsraten,10 was bei der Behandlung von Patienten mit Tumoren berücksichtigt werden muss.
Aus chirurgischer Sicht erhöht die Anzahl der Ebenen das Risiko einer Pseudarthrose, ebenso wie die Verwendung einer nicht starren Fixierung.9,11 Instrumentierung jeglicher Art erhöht die Fusionsrate gegenüber nicht instrumentierten Fusionen.12 In der Reihenfolge der Fusionsraten ergibt die Umfangsfusionsstelle die höchste (Interkörper sowie posterolateral), gefolgt von posteriorem Interkörper, anteriorem Interkörper und dann posterolateral.11 Es gibt Hinweise darauf, dass Titan-Zwischenkörpervorrichtungen schneller und häufiger verschmelzen als solche aus PEEK.13-15
Pedikel-Subtraktions-Osteotomie
Die Operation der Pedikel-Subtraktions-Osteotomie (PSO) wird sowohl aufgrund unserer größeren Wertschätzung der sagittalen Fehlstellung als auch aufgrund unserer alternden Bevölkerung in zunehmender Zahl durchgeführt.16 Eine der Hauptkomplikationen ist die Pseudarthrose, die bei etwa 10% der Patienten auftritt.17 Die Pseudarthrose tritt am häufigsten auf der Ebene der Osteotomie auf, und zu den Risikofaktoren gehören die Durchführung der Operation zur Behandlung einer bereits bestehenden Pseudarthrose, die präoperative Bestrahlung, das Vorhandensein einer neurologischen oder entzündlichen Erkrankung und das Fehlen einer Interkörperfusion direkt über der Osteotomie. Diese letzte Beobachtung wird durch Leichenstudien gestützt.18 Es scheint, dass Zwischenkörperkäfige die Fusionsraten verbessern, indem sie die Steifigkeit der Struktur erhöhen. Aus diesem Grund entscheiden sich die Autoren auch dafür, PSO-Konstrukten einen dritten Stab hinzuzufügen, von einer Ebene oberhalb bis zu einer Ebene unterhalb der Osteotomiestelle unter Verwendung von seitlichen Verbindern und einem Chrom-Kobalt-Stab, ähnlich der von Hyun et al.19
Wirbelsäulendeformitätschirurgie
In einer Studie zu Deformitätsoperationen, die das Kreuzbein umfassten, wurde eine Pseudarthroserate von 24% festgestellt.20 Alle Pseudarthrosen wurden vor vier Jahren nach der Operation nach durchschnittlich 27 Monaten festgestellt und traten entweder am thorakolumbalen Übergang oder am lumbosakralen Übergang auf. Die identifizierten Risikofaktoren waren thorakolumbale Kyphose und ein thorakoabdominaler Ansatz (für thorakolumbale Pseudarthrose), Osteoarthritis der Hüften und ein positives sagittales Gleichgewicht ≥ 5 cm (für lumbosakrale Pseudarthrose) und Alter > 55. Wie erwartet hatten die Patienten mit Pseudarthrose niedrigere Scores der Skoliose Research Society (SRS) als diejenigen mit einer soliden Fusion (71 vs. 90/120).
PRÄSENTATION
Pseudarthrose kann auf drei verschiedene Arten auftreten. Der Patient kann asymptomatisch sein und eine gute Funktion haben, er kann symptomatisch sein oder er kann eine Pseudarthrose haben, die mit einer anderen pathologischen Entität wie einer Infektion verbunden ist.
Funktionelle Ergebniswerte
Es bleibt unklar, warum viele Patienten mit Pseudarthrose asymptomatisch bleiben und gute funktionelle Ergebnisse haben. Eine kleine Studie aus dem Jahr 1968 verglich die Ergebnisse von Patienten mit Knochenfusion vs. Pseudarthrose und fand wenig Unterschied.21 Die Fusionsbeschreibung wird entweder als Hibbs- oder „H“ -Typ angegeben, und es kann daher angenommen werden, dass die Autoren nicht instrumentierte Fusionen durchgeführt haben. Eine modernere Studie von uninstrumentierten Fusionen fand nicht die gleichen Ergebnisse, wobei nur 56% der Patienten mit einer Pseudarthrose akzeptable Ergebnisse erzielten, verglichen mit 86% der Patienten mit einer festen Fusion.22
Wenn man sich Studien mit instrumentalisierten Fusionen ansieht, gibt es gemischte Beweise für die Korrelation zwischen solider Vereinigung und gutem Ergebnis. Eine Rezension von Resnick et al. „Die Mehrheit der medizinischen Beweise der Klasse III deutet darauf hin, dass eine erfolgreiche radiologische Fusion mit verbesserten klinischen Ergebnissen verbunden ist.“23 Einige dieser Studien waren randomisiert, wurden aber aufgrund hoher Crossover-Raten immer noch als Klasse III eingestuft.Bei einer Untersuchung von konsekutiven Deformitätspatienten an einer Einrichtung konnten alle Patienten mit einer nachgewiesenen Pseudarthrose nach einem Jahr oder länger ihre SRS- oder Oswestry Disability Index (ODI) -Werte nicht verbessern.24 In der Tat war das Fehlen einer Verbesserung dieser Werte bei der Erkennung von Pseudarthrose genauer als einfache Röntgenstrahlen. Dies wurde auch in der zuvor diskutierten Skoliosestudie festgestellt.20 Dieser Befund führt die Autoren zu dem Schluss, dass die funktionelle Ergebnisbewertung für die postoperative Überwachung von Deformitätspatienten unerlässlich ist und als Auslöser für weitere Untersuchungen auf Pseudarthrose dienen sollte.
Asymptomatische Pseudarthrose
Der Nachweis einer Pseudarthrose beim asymptomatischen Patienten ist in der Regel das Ergebnis einer Überwachung durch den Chirurgen und führt zu einer interessanten Überlegung. Wenn zum Beispiel ein Patient eine Pseudarthrose hat und dennoch asymptomatisch ist und gut funktioniert, kann man etwas gewinnen, wenn man ihn bestrahlt, um eine Anomalie zu finden, die höchstwahrscheinlich keinen chirurgischen Eingriff erfordert? Unter welchen Umständen wird der Nachweis einer Pseudarthrose das Management eines asymptomatischen Patienten durch den Chirurgen verändern? Es wäre vernünftig, dass nach einem mehrstufigen Verfahren oder einer Osteotomie die Früherkennung und Behandlung einer asymptomatischen Pseudarthrose katastrophale Komplikationen in der Zukunft verhindern kann. Dies kann mit Standard-Scoring-Systemen effektiv und effizient erfolgen. Nach einem einstufigen Verfahren ist es jedoch unwahrscheinlich, dass es in Zukunft zu größeren Komplikationen kommen würde, selbst wenn es sich nicht vereinigen würde, so dass das radiologische Screening möglicherweise weniger wichtig ist.
Symptomatische Pseudarthrose
Bei symptomatischer Pseudarthrose ist die Darstellung in der Regel eine Verschlechterung der axialen Rückenschmerzen. Der Schmerz kann eine Verschlechterung des ursprünglichen Schmerzes der Operation sein („nie besser geworden“) oder kann neu auftreten. Skoliose-Patienten können sich über eine Verschlechterung der Deformität beschweren, obwohl dies nicht häufig vorkommt. Im Falle einer ankylosierenden Spondylitis können Patienten empfindlich auf ihren visuellen Horizont reagieren. Neurologische Symptome sind ungewöhnlich, es sei denn, die Segmentdeformität ist beträchtlich.
Begleitende Pseudarthrose
Die wahrscheinlichste Begleitdiagnose ist eine Infektion. Eine Fieberanamnese, eine ungeplante Rückkehr in den Operationssaal, eine langfristige Antibiotikatherapie und die einer sich entladenden Wunde deuten stark auf eine Infektion hin. Gewichtsverlust und Unwohlsein können auch die Präsentation begleiten. Alle anderen Portale für Infektionen sollten untersucht werden.
UNTERSUCHUNG
Die Untersuchung einer vermuteten Pseudarthrose sollte wahrscheinliche Differential- oder Begleitdiagnosen berücksichtigen. Obwohl anfangs schwer zu interpretieren, sollten CRP und ESR untersucht werden, ebenso wie jedes andere Blut, das auf eine Infektion hindeutet. Die Wunde sollte untersucht und jede Weichteilschwellung oder -ansammlung dokumentiert werden. Jede Flüssigkeitssammlung sollte beprobt und zur Mikroskopie, Kultur und Empfindlichkeitsprüfung geschickt werden. Selbst präoperative Untersuchungen können Infektionen von geringem Grad übersehen, daher muss der Chirurg vorbereitet sein, falls bei der Revision eitrige Flüssigkeit auftritt.
Bildgebende Studien
Statistische Analyse
Jede Diskussion über bildgebende Studien oder andere diagnostische Tests muss eine Bewertung der Sensitivität und Spezifität sowie der 𝜅 (Kappa) -Werte beinhalten. Jeder Chirurg muss mit diesen Begriffen vertraut sein, und wie sie verwendet werden können, um unsere Entscheidungsfindung zu leiten. Zum Lesen des folgenden Textes werden die Tests als Versuch analysiert, eine Fusion zu erkennen. Daher bezieht sich die Sensitivität auf die Chance, eine Fusion korrekt zu identifizieren, während sich die Spezifität auf die Chance bezieht, eine Pseudarthrose korrekt zu identifizieren.Ein Test mit niedriger Empfindlichkeit kann eine feste Fusion „verfehlen“ und den Chirurgen dazu ermutigen, unnötige Eingriffe durchzuführen, um eine scheinbare Pseudarthrose zu beheben, die tatsächlich fest ist. Ein Test mit geringer Spezifität hingegen kann eine Pseudarthrose „verfehlen“ und den Chirurgen und Patienten davon abhalten, dass die Fusion solide ist, obwohl dies tatsächlich nicht der Fall ist.
Der Kappa-Wert oder Cohens Kappa-Koeffizient ist ein Maß für die Übereinstimmung zwischen Beobachtern und variiert zwischen 0 (keine Übereinstimmung oder nur zufällige Übereinstimmung) und 1 (perfekte Übereinstimmung). Ein Wert von 0,41-0.60 wird als moderate Übereinstimmung und 0,61-0,80 als wesentliche Übereinstimmung angesehen. Werte über 0,81 gelten in der Biomedizin als „nahezu perfekte“ Übereinstimmung.25 Die praktische Bedeutung davon ist, dass selbst wenn ein Test eine hohe Sensitivität und Spezifität aufweist, ein niedriger Kappa-Wert dem Chirurgen signalisieren sollte, dass das tatsächliche Ergebnis stark beobachterabhängig sein kann. Eine Möglichkeit, dies zu umgehen, kann darin bestehen, einen Konsens zu erzielen, indem die Ergebnisse mehreren Spezialisten präsentiert werden.
X-rays
Plain X-rays
Zwei der besten Studien, die sich mit einfachen Röntgenaufnahmen befassen, sind die von Brodsky und Kant.26,27 Ihre Ergebnisse waren ziemlich ähnlich. Die Korrelation zwischen einfachen statischen Röntgenstrahlen und chirurgischer Exploration betrug 64-68%, mit einer Empfindlichkeit von 85-89%, aber einer geringen Spezifität von 60-62%. Wenn ein Röntgenbild eine feste Fusion zeigt, mit anderen Worten, dann ist es wahrscheinlich fest, aber wenn es auf eine Pseudarthrose hindeutet, dann kann man sich nicht darauf verlassen. Die Zeit von der Operation bis zur Erkennung einer Pseudarthrose durch Röntgen ist mit durchschnittlich 3,5 Jahren ebenfalls recht lang.20
Ein weiteres Problem ist die große Variabilität bei der Interpretation von Röntgenstrahlen, sowohl inter- als auch intra-Beobachter. In einer Studie, in der Röntgenstrahlen von zwei Chirurgen und zwei Radiologen beurteilt wurden, war 𝜅 = 0,4-0,7, was auf eine schlechte Korrelation hinweist. Daher empfehlen die Autoren sie trotz der relativ geringen Kosten einfacher Röntgenstrahlen und ihrer Verfügbarkeit nicht für die Beurteilung der Festkörperfusion.
Biege- oder dynamische Röntgenstrahlen
Biege- oder dynamische Filme, auch Flexion-Extension-Studien genannt, verhalten sich bei der Untersuchung von Pseudarthrosen ähnlich wie normale Röntgenstrahlen. In der gleichen Studie von Brodsky et al. wie oben erwähnt, wurde festgestellt, dass eine Bewegungsfreiheit in diesen Studien zwar gut mit einer festen Fusion korrelierte, Bewegung jedoch nicht unbedingt auf eine Pseudarthrose hinweist.26
Computertomographie (CT)
In der bereits diskutierten Studie von Brodsky et al. Bei der CT-Untersuchung wurde nur eine Sensitivität von 63%, eine Spezifität von 86%, ein positiver Vorhersagewert von 72% und ein negativer Vorhersagewert von 81% festgestellt. Diese Ergebnisse unterschieden sich nicht dramatisch von einfachen Röntgenaufnahmen, aber man muss bedenken, dass diese Studie und viele ähnliche in den späten 1980s durchgeführt wurden. Es sollte daher nicht überraschen, dass modernere Studien mit moderneren helikalen Mehrschichtscannern viel bessere Ergebnisse gezeigt haben. Leider haben nicht viele die Bildgebung mit der chirurgischen Erforschung verglichen.
Posterolaterale Fusionen
Zwei neuere Studien verglichen CT-Scan-Befunde mit chirurgischer Exploration. In ihrer Arbeit von 2007,28 Carreon et al. verwendet 1 mm axiale Scheibe CT-Scans auf Film gedruckt und hatte sie von drei Wirbelsäulenchirurgen beurteilt. Interessanterweise dokumentierten sie die Fusion über das Facettengelenk sowie die Fusion in den posterolateralen Rinnen. Wenn die Fusion in beiden Facetten und in beiden posterolateralen Rinnen beobachtet wurde, betrug die Wahrscheinlichkeit einer soliden Fusion bei der Exploration 96%. Wenn es nur in den posterolateralen Rinnen gesehen wurde, dann fiel dies auf 89%, und schließlich, wenn es nur Fusion über die Facettengelenke gesehen wurde, dann war die Chance, eine solide Fusion bei der Exploration zu sehen, 74%. Das Fehlen einer Fusion über beide Facettengelenke oder eine posterolaterale Rinne sagte die Pseudarthrose bei der Exploration jedoch nicht zuverlässig voraus.
Anteriore lumbale Interkörperfusionen (ALIF)
In der zweiten Arbeit, die sich mit anterioren lumbalen Interkörperfusionen unter Verwendung von Metallkäfigen von Carreon et al.,29 wurde ein ähnliches Protokoll verwendet. Obwohl es eine erhebliche Variabilität unter den Beobachtern gab, hatte der CT-Scan eine Sensitivität von 93% und eine Spezifität von 46% für die Fusion, als ein Konsens erzielt wurde. Das vordere Sentinel-Zeichen30 hatte nur eine Sensitivität von 20% und eine Spezifität von 92% für den Nachweis einer Fusion, während sich das hintere Sentinel-Zeichen mit 67% Sensitivität und 79% Spezifität als genauer erwies. Das Fehlen eines vorderen Sentinelzeichens ist ein guter Test für Pseudarthrose.
Posteriore/Transforaminale lumbale Interkörperfusionen (PLIF/TLIF)
Die Beurteilung der Interkörperfusion ist oft problematisch. Artefakte können die CT-Bildgebung häufig beeinträchtigen, insbesondere wenn sie an alten Maschinen durchgeführt werden, und Tantalmarker in PEEK- oder Kohlefaserkäfigen können häufig ein dramatisches Artefakt hinterlassen (Abb. 4-1). Moderne mehrschichthelikale Maschinen mit ausgefeilteren Artefaktentfernungsalgorithmen haben die Aufgabe viel einfacher gemacht, und Rekonstruktionen der Koronalebene sind hervorragend zur Visualisierung der Interkörperfusionsmasse geeignet.
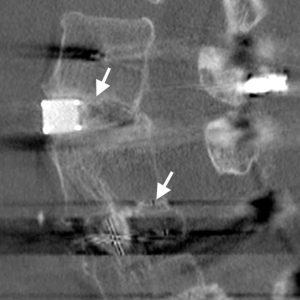
Shah et al.31 führten CT-Scans bei Patienten 6 Monate postoperativ durch, die sich einer PLIF mit Titankäfigen unterzogen hatten, wobei das einzige Knochentransplantat in den Käfigen verpackt war. Er beschrieb die Überbrückung der Knochentrabekulation sowohl innerhalb der Käfige als auch außerhalb der Käfige, in denen kein Knochentransplantat gepackt worden war. Ähnlichkeiten mit dem Sentinel-Zeichen wurden festgestellt. Er fand auch heraus, dass CT bei der Bestimmung des Vorhandenseins oder Fehlens einer radioluzenten Endplattenkäfiggrenzfläche weitaus empfindlicher war als Röntgen, mit sehr hoher Übereinstimmung zwischen den Beobachtern. Fogel et al., 32 andererseits fest, dass es bei der Beurteilung der Fusion nach PLIF nur einen geringen Unterschied zwischen CT-Scans und Röntgenaufnahmen gab. Die Schwierigkeit mit dem Papier ist jedoch, dass es nur vier Pseudarthrose Fälle bei der Exploration von 172 Ebenen chirurgisch untersucht gefunden wurden. Mit einer so niedrigen Pseudarthrose Rate von 2.3% können Sensitivitäts- und Spezifitätsberechnungen mit relativ geringen Änderungen der Detektion stark beeinflusst werden.
Ein sehr nützliches Papier von Kanemura et al.33 verfolgte radiologische Veränderungen im Laufe der Zeit. Sie untersuchten 153 Patienten bis zu fünf Jahre postoperativ nach PLIF mit lokalem Knochentransplantat und Beckenkamm. Sie fanden heraus, dass die Bewegung ≥ 5 ° auf dynamischen Röntgenstrahlen nach einem Jahr maximal war, dann aber mit der Zeit stetig abnahm. Ebenso fanden Sie heraus, dass mit Röntgen-und CT-Scanning, strahlendurchlässige Zonen um Pedikelschrauben waren auch maximal nach einem Jahr, aber dann aufgelöst, ohne chirurgischen Eingriff von drei bis vier Jahren. Der vordere Brückenknochen begann sich nach drei Monaten zu bilden und setzte sich dann fort. Das Knochentransplantatvolumen zwischen den Körpern nahm tendenziell um 6 Monate ab, stieg dann aber nach zwei bis drei Jahren wieder an.Mit so vielen Veränderungen im Zusammenhang mit Pseudarthrose, die an der 6- bis 12-monatigen postoperativen Marke vorhanden sind, fordert dieses Papier den Chirurgen auf, den chirurgischen Eingriff für Pseudarthrose zu verzögern, bis mindestens zwei oder drei Jahre vergangen sind, da viele Veränderungen ohne Intervention verschwinden werden. Sind irgendwelche der Veränderungen mit der eventuellen Diagnose einer Pseudarthrose verbunden? Der einzige gefundene Prädiktor war das Vorhandensein einer radioluzenten Zone um den Zwischenkörperkäfig von mehr als 1 mm nach 12 und 18 Monaten. Dies war ein unabhängiger Prädiktor und verbunden mit Absenkung, Bewegung und abnehmendem Knochentransplantat zwischen den Körpern.
Magnetresonanztomographie
Obwohl es einige Studien zur Genauigkeit der MRT gegeben hat,34,35 Es wurde nicht günstig mit CT oder operativer Exploration verglichen. Es kann dem Chirurgen Informationen über die modischen Veränderungen geben, die über den fusionierten Bandscheibenraum vorhanden sind, aber es wurde nicht gezeigt, dass dies zuverlässig mit Fusion oder Pseudarthrose korreliert.
Röntgenstereophotogrammetrische Analyse (RSA)
RSA ist eine Technik, bei der Tantalmarker zum Zeitpunkt der Operation in die Knochenwirbel eingebettet werden. In der postoperativen Phase wird dann eine standardisierte Bildgebung der Perlen erstellt, und die Bewegung kann genau gemessen werden.36 Diese Technik hat ein ähnliches Problem wie dynamische Röntgenstrahlen, da Bewegung oder deren Fehlen nicht unbedingt mit einer Pseudarthrose korreliert. Zum Beispiel kann es laut RSA unmittelbar nach der Operation keine Bewegung über ein Segment geben, aber offensichtlich hat sich noch keine Fusion etabliert.37 Es wird nur zu Forschungszwecken verwendet, und die klinische Korrelation mit der Fusion sollte sorgfältig hergestellt werden.
Nuklearmedizin
Technetium-99m Knochenscanning wird häufig verwendet, um die Aktivität von Knochen um eine Fusionsmasse zu beurteilen. Es wird angenommen, dass es mit der Fusion korreliert, da der Scan „kalt“ ist. Beweise für seine Nützlichkeit fehlen jedoch. Im Vergleich zur chirurgischen Untersuchung war sie zwar spezifisch (93%), hatte jedoch keine Sensitivität (50%) und hatte bei der Suche nach Pseudarthrose nur einen positiven Vorhersagewert von 40%.38 Ähnliche Ergebnisse wurden bei Skoliose-Patienten gefunden.39 Es wird angenommen, dass das Hauptproblem darin besteht, dass die Technik nicht in der Lage ist, zwischen etablierter Pseudarthrose und unreifer Fusionsmasse zu unterscheiden.
Ultraschall
Die Verwendung von Ultraschall wurde in einer kleinen Studie untersucht, in der das Erscheinungsbild der hinteren Strukturen mit der chirurgischen Untersuchung verglichen wurde.40 Obwohl es vielversprechend zu sein schien, ist es in seiner Fähigkeit, die vordere Fusionsmasse zu beurteilen, begrenzt. Es wurden keine weiteren Studien durchgeführt.
KLASSIFIKATION
Posterolaterale Fusion
Heggeness und Esses waren die ersten, die morphologisch verschiedene Arten von Pseudarthrose von posterolateralen Fusionen klassifizierten (Tabelle 4-1).41 Sie beschrieben auch das „Schindelzeichen“, das häufig beim Schindeltyp der Pseudarthrose auftritt, bei dem ein Knochenbruch beim Betrachten einer axialen CT-Schicht hinter den hinteren Elementen schwebt. Diese Klassifizierung ist insofern nützlich, als sie auf die Ursache der Pseudarthrose hindeutet.
| Typ | Beschreibung |
| Atrophisch | Atrophie und Resorption der Fusionsknochenmasse |
| Transversal | ausreichende Knochenmasse, aber eine horizontale Diskontinuität bleibt bestehen |
| Schindel | Variation der transversalen, wo die Diskontinuität schräg ist |
| Komplex | das Vorhandensein mehrerer Fusionsdefekte |
Lenke et al.42 beschrieben eine qualitativere Klassifizierung der posterolateralen Fusionsmasse, die von A „definitiv fest“ bis D „definitiv nicht fest“ reicht (Tabelle 4-2). Während dies nützlich sein kann, um Fusionen zu beschreiben, gibt es dem Chirurgen Hilfe bei der Diagnose oder Behandlung der Komplikation.
| Typ | Kurzschrift | Beschreibung |
| A | definitiv fest | solide große trabekulierte bilaterale Fusionsmassen |
| B | möglicherweise fest | einseitig große Fusionsmasse mit kontralateraler kleiner Fusionsmasse |
| C | wahrscheinlich nicht fest | kleine, dünne Fusionsmassen bilateral |
| D | definitiv nicht fest | bilaterale Transplantatresorption oder Fusionsmasse mit offensichtlicher bilateraler Pseudarthrose |
Interbody Fusion
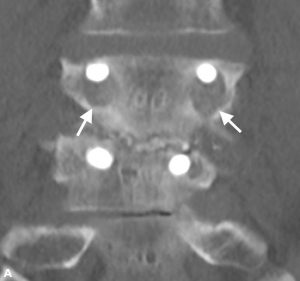
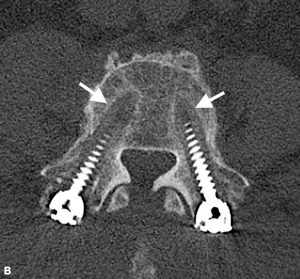
Brantigan und Steffee beschrieben zunächst eine Klassifizierung der Interbody Fusion durch ihren Kohlefaserkäfig.43 Später von Fraser modifiziert, ist es normalerweise als BSF-Klassifikation (Brantigan, Steffee, Fraser) bekannt (Tabelle 4-3).32,44 Pseudarthrose wird durch CT-Scan ausgewertet und als BSF-1 klassifiziert, wenn grobe Bewegungszeichen vorliegen (Abb. 4-2) oder BSF-2, wo eine horizontale Luzenz über den Interkörperraum besteht (Abb. 4-3). Letzteres ist in der Regel als „locked Pseudarthrose“ bekannt. In Bezug auf die Fusion betrachteten sie die Fusion als solide, wenn Knochen durch einen der PLIF-Käfige wachsen, selbst wenn der andere durchsichtig war.
| Beschreibung | |
| BSF-1 | Die radiographische Pseudarthrose wird durch
er Bandscheibenhöhe |
| BSF-2 | Radiographisch gesperrte Pseudarthrose wird durch lucency sichtbar in die Mitte der Käfige mit festem Knochen, der von jeder Wirbelendplatte in den Käfig hineinwächst. |
| BSF-3 | Radiographische Fusion: Knochen überbrückt mindestens die Hälfte des Fusionsbereichs mit mindestens der Dichte, die ursprünglich bei der Operation erreicht wurde. |
CHIRURGISCHE STRATEGIEN
Die Entscheidung, einen chirurgischen Eingriff anzubieten, muss immer ein Gleichgewicht zwischen Risiken und Nutzen sein. Ein asymptomatischer Patient mit einer einstufigen Pseudarthrose erfordert möglicherweise keine Intervention, aber ein Patient mit einer langen Fusion, auch wenn asymptomatisch, kann in Betracht gezogen werden, um zu vermeiden, dass zukünftige Operationen viel schwieriger werden. Es ist zu beachten, dass Patienten, die an einer Pseudarthrose gelitten haben, auch nach erfolgreicher Fusion nicht so gut abschneiden wie Patienten, die nach ihrer ersten Operation eine erfolgreiche Fusion hatten.5
Ansatz
Die Variationen bei der chirurgischen Behandlung einer Pseudarthrose sind so vielfältig wie die Methoden zur Durchführung einer Fusion. Die allgemeinen Prinzipien, die befolgt werden müssen, sind die Verbesserung der Stabilisierung, die Durchführung einer neuen Transplantation und die Wiederherstellung der sagittalen Ausrichtung.45 Um die Stabilisierung zu verbessern, sollten deutlich lose und defekte Instrumente ausgetauscht werden. Oft können Pedikelschrauben um ein oder zwei Millimeter Durchmesser „vergrößert“ werden, um einen guten Halt in einer zuvor losen Schraubenbahn zu erreichen. Manchmal ist auch eine Verlängerung der Schrauben möglich, erfordert jedoch eine sorgfältige präoperative Planung. Die Verlängerung der Fixierung auf ein angrenzendes Segment sollte in Betracht gezogen werden, insbesondere wenn es mit einer Erkrankung des benachbarten Segments verbunden ist, aber man muss bedenken, dass die neu eingebauten Ebenen auch eine Fusion erreichen müssen. Im praktischen Sinne ist bei einer fehlgeschlagenen lumbosakralen Fusion die Verlängerung der Fixierung auf das Ilium oft sehr effektiv, um die Stabilisierung zu verbessern.46
Die Zugabe von Zwischenkörpertransplantat zu einer fehlgeschlagenen posterolateralen Fusion ist ein Mittel zur Zugabe von Transplantatmaterial unter Kompression sowie zur Verbesserung der Stabilisierung. Durch Ersetzen eines „weichen“ Bandscheibenraums durch eine relativ steifere Kombination aus Käfig und Transplantat wird die Unterstützung der vorderen Säule verbessert. Je nach Niveau kann dies entweder über einen anterioren oder lateralen Ansatz erfolgen. Eine TLIF- oder PLIF-Technik kann ebenfalls verwendet werden, diese stoßen jedoch höchstwahrscheinlich auf Narbengewebe und erhöhen das Risiko von Nervenverletzungen und Duralrissen.
Sagittales Gleichgewicht
Das sagittale Gleichgewicht muss immer gemessen und berücksichtigt werden. Ein Patient mit einer Pseudarthrose in schlechter sagittaler Ausrichtung hat immer noch ein schlechtes Ergebnis mit einer festen Fusion, wenn ihre Ausrichtung nicht angesprochen wird. Eine Osteotomie durch eine Pseudarthrose kann notwendig sein, um eine Korrektur zu erreichen, aber noch einmal muss der Chirurg die Chance der Fusion optimieren, indem er eine gute Knochenapposition, steife und starke Konstrukte erreicht und die eigenen Risikofaktoren des Patienten verbessert.
Stimulation
Es gibt einige Forschungsergebnisse, die die Verwendung von Gleichstromstimulatoren unterstützen,47,48 sowie gepulste elektromagnetische Feldstimulation.49-51 Leider hat keine der beiden Methoden durchweg gute Ergebnisse gezeigt und ist weitgehend aus der breiten Anwendung geraten.
Knochentransplantat
Es gibt keinen synthetischen Ersatz für Beckenkammtransplantate, und dies sollte immer die Quelle für Transplantatmaterial sein, wann immer es für die Behandlung von Pseudarthrose verfügbar ist. Während rhBMP-2 in zwei großen systematischen Übersichten als äquivalent zu autologem Knochentransplantat gezeigt wurde,52,53 Es ist nicht ohne Kosten oder Komplikationen. Allografts fehlen osteoinduktive Eigenschaften wie Keramiken wie Tricalciumphosphat, und wenn der Chirurg eine Pseudarthrose behandelt, sollten biologisch inerte „Füllstoffe“ wie diese vermieden werden.
FAZIT
Die Pseudarthrose ist nach wie vor eines der schwierigsten Probleme des Wirbelsäulenchirurgen, und das Risiko sollte mit allen potenziellen Fusionspatienten besprochen werden. Die Minimierung der Risiken einer Pseudarthrose beginnt lange bevor das Skalpell die Haut berührt, mit präoperativen Untersuchungen abgeschlossen, Planung durchgeführt, und alle Risikofaktoren gemildert.
Jeder Fusionspatient, der nicht auf die übliche Weise anspricht, sollte dem Chirurgen die Möglichkeit einer Pseudarthrose mitteilen. Der Chirurg, der den Patienten „beschuldigt“, wird seinem Patienten oder sich selbst nicht gerecht. Relevante Untersuchungen umfassen Röntgenaufnahmen und CT-Scans; subtile Veränderungen im Laufe der Zeit sollten beachtet werden.
Sobald die Diagnose gestellt ist, sollte eine sorgfältige und offene Diskussion über die Vorteile und Risiken eines chirurgischen Eingriffs stattfinden, da diese Entscheidung nicht immer klar ist. Sobald der chirurgische Eingriff entschieden ist, muss der Chirurg die Art des Versagens sowie die notwendigen Schritte berücksichtigen, um eine Fusion in einer akzeptablen Ausrichtung zu erreichen. Leider kann nicht erwartet werden, dass der operative und postoperative Verlauf routinemäßig ist, und man muss den Patienten warnen, dass er möglicherweise nie das erwartete Ergebnis seiner Indexoperation erzielt.
PERLEN UND FALLSTRICKE
- Planen und bereiten Sie bei Patienten mit einem hohen Risiko für die Entwicklung einer Pseudarthrose eine Operation vor, die diese Risiken mindert. Die Instrumentierung verbessert die Fusionsrate, ebenso wie die Durchführung von 360 ° -Fusionen entweder durch zwei separate Ansätze oder mit Interkörper- sowie bilateralen posterolateralen Transplantaten.
- Vermuten, dass ein Patient eine Pseudarthrose entwickelt, wenn sich seine funktionellen Ergebniswerte nicht wie erwartet verbessern.
- CT-Rekonstruktionen auf koronaler Ebene sind die Untersuchung der Wahl, um eine Pseudarthrose und insbesondere eine „gesperrte Pseudarthrose“ zu finden.“
- Lockerung um Schrauben sollte mit der Zeit lösen und sollte sorgfältig befolgt werden, aber lucency um einen Zwischenkörperkäfig ist wahrscheinlich der Vorläufer einer eventuellen Pseudarthrose sein.
- Autologes Knochentransplantat sollte das Transplantationsmaterial der Wahl sein.
EMPFOHLENE LEKTÜRE
- Choudhri TF, Mummaneni PV, Dhall SS, et al. Leitlinienaktualisierung für die Durchführung von Fusionsverfahren bei degenerativen Erkrankungen der Lendenwirbelsäule. Teil 4: Radiologische Beurteilung des Fusionsstatus. J Neurochirurgie. 2014;21(1):23-30.
- Lee C, Dorcil J, Radomisli TE. Nonunion der Wirbelsäule: eine Überprüfung. Clin Orthop Relat Res. 2004;(419):71-75.
- Resnick DK, Choudhri TF, Dailey AT, et al. Richtlinien für die Durchführung von Fusionsverfahren bei degenerativen Erkrankungen der Lendenwirbelsäule. Teil 4: radiologische Beurteilung der Fusion. J Neurochirurgie. 2005;2(6):653-657.
- Adogwa O, Parker SL, Shau D, et al. Kosten pro qualitätsbereinigtem Lebensjahresergebnis der Revisionsfusion bei lumbaler Pseudoarthrose: Definition des Wertes der Operation. In: J Spinal Disorder. 2015;28(3):101-105.
- Chun DS, Bäcker KC, Hsu WK. Lumbale Pseudarthrose: eine Überprüfung der aktuellen Diagnose und Behandlung. Schwerpunkt Neurochirurgie. 2015;39(4):E10.Raizman NM, O’Brien JR., Poehling-Monaghan KL., Yu WD. Pseudarthrose der Wirbelsäule. J Am Acad Orthop Surg. 2009;17(8):494-503.
- Hadley MN, Reddy SV. Rauchen und die menschliche Wirbelsäule: Eine Überprüfung der Auswirkungen des Zigarettenkonsums auf den Wirbelknochenstoffwechsel und die Wirbelsäulenfusion. Neurochirurgie. 1997;41(1):116-124.
- Gertzbein SD, Hollopeter MR, Hall S. Pseudarthrose der Lendenwirbelsäule. Ergebnis nach Umfangsfusion. Wirbelsäule. 1998;23(21): 2352-2356; Diskussion 2356-2357.
- Braun CW, Orme TJ, Richardson HD. Die Rate der Pseudarthrose (chirurgische Nonunion) bei Rauchern und Nichtrauchern: eine Vergleichsstudie. Wirbelsäule. 1986;11(9):942-943.
- Bydon M, De la Garza-Ramos R, Abt NB, et al. Einfluss des Rauchens auf Komplikations- und Pseudarthroseraten nach ein- und 2-stufiger posterolateraler Fusion der Lendenwirbelsäule. Wirbelsäule. 2014;39(21):1765-1770.
- Jenkins JD, Coric D, Branch CL Jr. Ein klinischer Vergleich der Ein- und Zweischrauben-Odontoidfixierung. J Neurochirurg. 1998;89(3):366-370.
- Deguchi M, Rapoff AJ, Zdeblick TA. Posterolaterale Fusion für isthmische Spondylolisthesis bei Erwachsenen: Analyse der Fusionsrate und der klinischen Ergebnisse. J Wirbelsäulendisord. 1998;11(6):459-464.
- Boden SD, Sumner DR. Biologische Faktoren, die die Wirbelsäulenfusion und Knochenregeneration beeinflussen. Wirbelsäule. 1995;20(24 Suppl):102S-112S.
- Bono CM, Lee CK. Kritische Analyse der Fusionstrends bei degenerativen Bandscheibenerkrankungen in den letzten 20 Jahren: Einfluss der Technik auf die Fusionsrate und das klinische Ergebnis. Wirbelsäule. 2004; 29(4): 455-463; Diskussion Z5.
- Zdeblick TA. Eine prospektive, randomisierte Studie zur lumbalen Fusion. Vorläufige Ergebnisse. Wirbelsäule. 1993;18(8):983-991.
- Nemoto O, Asazuma T, Yato Y, Imabayashi H, Yasuoka H, Fujikawa A. Vergleich der Fusionsraten nach transforaminaler lumbaler Zwischenkörperfusion unter Verwendung von Polyetheretherketonkäfigen oder Titankäfigen mit transpedikulärer Instrumentierung. Eur. J. 2014;23(10):2150-2155.
- Wu SH, Li Y, Zhang YQ, et al. Poröser Titan-6-Aluminium-4-Vanadium-Käfig hat eine bessere Osseointegration und weniger Mikrobewegung als ein Polyether-Ether-Keton-Käfig bei der Wirbelfusion von Schafen. Artif Organe. 2013;37(12): E191-E201.
- Olivares-Navarrete R, Gittens RA, Schneider JM, et al. Osteoblasten weisen auf Titanlegierungssubstraten einen differenzierteren Phänotyp und eine erhöhte knochenmorphogenetische Proteinproduktion auf als auf Polyether-Ether-Keton. Wirbelsäule J. 2012; 12(3): 265-272.
- Bridwell KH, Lewis SJ, Lenke LG, Baldus C, Blanke K. Pedikel-Subtraktions-Osteotomie zur Behandlung von fixiertem sagittalem Ungleichgewicht. J Knochengelenk Surg Am. 2003;85-A(3): 454-463.
- Dickson DD, Lenke LG, Bridwell KH, Koester LA. Risikofaktoren für und Beurteilung der symptomatischen Pseudarthrose nach lumbaler Pedikelsubtraktionsosteotomie bei Wirbelsäulendeformität bei Erwachsenen. Wirbelsäule. 2014;39(15):1190-1195.
- Deviren V, Tang JA, Scheer JK, et al. Konstruieren Sie die Steifigkeit nach Ermüdungsbelastung in der Pedikelsubtraktionsosteotomie mit oder ohne benachbarte Zwischenkörperstrukturkäfige. Globale Wirbelsäule J. 2012; 2 (4): 213-220.
- Hyun SJ, Lenke LG, Kim YC, Koester LA, Blanke KM. Langfristige radiologische Ergebnisse eines zentralen Hakenstabkonstrukts für Osteotomieverschluss: mindestens 5 Jahre Follow-up. Wirbelsäule. 2015;40(7): E428-E432.
- Kim YJ, Bridwell KH, Lenke LG, Rhim S, Cheh G. Pseudarthrose bei langer Wirbelsäulendeformität bei Erwachsenen und Fusion mit dem Kreuzbein: Prävalenz- und Risikofaktorenanalyse von 144 Fällen. Wirbelsäule. 2006;31(20):2329-2336.
- DePalma AF, Rothman RH. Die Art der Pseudarthrose. Clin Orthop Relat Res. 1968;59:113-118.
- Kornblum MB, Fischgrund JS, Herkowitz HN, Abraham DA, Berkower DL, Ditkoff JS. Degenerative lumbale Spondylolisthesis mit Spinalstenose: eine prospektive Langzeitstudie zum Vergleich von Fusion und Pseudarthrose. Wirbelsäule. 2004; 29 (7): 726-733; Diskussion 733-734.
- Resnick DK, Choudhri TF, Dailey AT, et al. Richtlinien für die Durchführung von Fusionsverfahren bei degenerativen Erkrankungen der Lendenwirbelsäule. Teil 5: Korrelation zwischen radiographischem und funktionellem Ergebnis. J Neurochirurgie. 2005;2(6):658-661.
- Klineberg E, Gupta M, McCarthy I, Hostin R. Nachweis von Pseudarthrose bei erwachsenen Wirbelsäulendeformität: die Verwendung von gesundheitsbezogenen Lebensqualität Ergebnisse Pseudarthrose vorherzusagen. Clin Spine Surg. 2016;29(8):318-322.
- Landis JR., Koch GG. Die Messung der Beobachtervereinbarung für kategoriale Daten. Biometrischer. 1977;33(1):159-174.
- Brodsky AE, Kovalsky ES, Khalil MA. Korrelation der radiologischen Beurteilung von Lendenwirbelsäulenfusionen mit chirurgischer Untersuchung. Wirbelsäule. 1991;16(6 Ergänzungen): S261-S265.
- Kant AP, Daum WJ, Dean SM, Uchida T. Bewertung der Lendenwirbelsäulenfusion. Einfache Röntgenaufnahmen versus direkte chirurgische Untersuchung und Beobachtung. Wirbelsäule. 1995;20(21):2313-2317.
- Carreon LY, Djurasovic M, Glassman SD, Sailer P. Diagnostische Genauigkeit und Zuverlässigkeit von Feinschnitt-CT-Scans mit Rekonstruktionen zur Bestimmung des Status einer instrumentierten posterolateralen Fusion mit chirurgischer Exploration als Referenzstandard. Wirbelsäule. 2007;32(8):892-895.
- Carreon LY, Glassman SD, Schwender JD, Subach BR, Gornet MF, Ohno S. Zuverlässigkeit und Genauigkeit von fein geschnittenen Computertomographien zur Bestimmung des Status von anterioren Interkörperfusionen mit metallischen Käfigen. Wirbelsäule J. 2008; 8(6): 998-1002.
- McAfee PC. Interbody Fusion hilft bei rekonstruktiven Operationen an der Wirbelsäule. J Knochengelenk Surg Am. 1999;81(6):859-880.
- Schah RR, Mohammed S, Saifuddin A, Taylor BA. Vergleich von einfachen Röntgenaufnahmen mit CT-Scan zur Bewertung der Interkörperfusion nach Verwendung von Titan-Interkörperkäfigen und transpedikulären Instrumenten. Eur. J. 2003;12(4):378-385.
- Fogel GR, Toohey JS, Neidre A, Brantigan JW. Fusionsbewertung der posterioren lumbalen Zwischenkörperfusion mit strahlendurchlässigen Käfigen: Röntgenfilme und helikale Computertomographie-Scans im Vergleich zur chirurgischen Erforschung der Fusion. Wirbelsäule J. 2008; 8 (4): 570-577.
- Kanemura T, Matsumoto A, Ishikawa Y, et al. Radiologische Veränderungen bei Patienten mit Pseudarthrose nach posteriorer lumbaler Interkörperarthrodese unter Verwendung von Kohlenstoff-Interkörperkäfigen: eine prospektive Fünfjahresstudie. J Knochengelenk Surg Am. 2014;96(10):e82.
- Kröner AH, Eyb R, Lange A, Lomoschitz K, Mahdi T, Engel A. Magnetresonanztomographische Auswertung der posterioren lumbalen Interkörperfusion. Wirbelsäule. 2006;31(12):1365-1371.
- Lang P, Chafetz N, Genant HK, Morris JM. Lendenwirbelsäulenfusion. Beurteilung der funktionellen Stabilität mit Magnetresonanztomographie. Wirbelsäule. 1990;15(6):581-588.
- Johnsson R, Selvik G, Strömqvist B, Sundén G. Mobilität der unteren Lendenwirbelsäule nach posterolateraler Fusion bestimmt durch röntgenstereophotogrammetrische Analyse. Wirbelsäule. 1990;15(5):347-350.
- Johnsson R, Axelsson P, Gunnarsson G, Strömqvist B. Stabilität der lumbalen Fusion mit transpedikulärer Fixation bestimmt durch röntgenstereophotogrammetrische Analyse. Wirbelsäule. 1999;24(7):687-690.
- Bohnsack M, Gossé F, Rühmann O, Wenger K. Der Wert der Szintigraphie bei der Diagnose einer Pseudarthrose nach einer Wirbelsäulenfusionsoperation. J Wirbelsäulendisord. 1999;12(6):482-484.
- McMaster MJ, Merrick MV. Die szintigraphische Beurteilung der skoliotischen Wirbelsäule nach der Fusion. J Knochengelenk Surg Br. 1980;62-B(1):65-72.
- Jacobson JA, Starok M, Pathria MN, Garfin SR. Pseudarthrose: US-Bewertung nach posterolateraler Wirbelsäulenfusion: in Arbeit. Radiologie. 1997;204(3):853-858.
- Heggeness MH, Esses SI. Klassifizierung von Pseudarthrosen der Lendenwirbelsäule. Wirbelsäule. 1991;16(8 Ergänzungen): S449-S454.
- Lenke LG, Bridwell KH, Bullis D, Betz RR, Baldus C, Schönecker PL. Ergebnisse der in situ Fusion für isthmische Spondylolisthesis. J Wirbelsäulendisord. 1992;5(4):433-442.
- Brantigan JW, Steffee AD. Ein Kohlefaserimplantat zur Unterstützung der lumbalen Fusion zwischen den Körpern. Zweijährige klinische Ergebnisse bei den ersten 26 Patienten. Wirbelsäule. 1993;18(14):2106-2107.
- Santos ER, Goss DG, Morcom RK, Fraser RD. Radiologische Beurteilung der Zwischenkörperfusion unter Verwendung von Kohlefaserkäfigen. Wirbelsäule. 2003;28(10):997-1001.
- Larsen J, Capen DA. Pseudarthrose der Lendenwirbelsäule. J Am Acad Orthop Surg. 1997;5(3):153-162.
- Kuklo TR, Bridwell KH, Lewis SJ, et al. Mindestens 2-Jahres-Analyse der Sacropelvic-Fixierung und L5-S1-Fusion mit S1- und Iliakalschrauben. Wirbelsäule. 2001;26(18):1976-1983.
- Tejano NA, Puno R, Ignacio JM. Die Verwendung implantierbarer Gleichstromstimulation bei der mehrstufigen Wirbelsäulenfusion ohne Instrumentierung. Eine prospektive klinische und radiologische Bewertung mit Langzeit-Follow-up. Wirbelsäule. 1996;21(16):1904-1908.
- Goodwin CB, Brighton CT, Guyer RD, Johnson JR., Licht KI, Yuan HA. Eine Doppelblindstudie zur kapazitiv gekoppelten elektrischen Stimulation als Ergänzung zu Lendenwirbelsäulenfusionen. Wirbelsäule. 1999;24(13): 1349-1356; Diskussion 1357.
- Hodges SD, Eck JC, Humphreys SC. Verwendung der elektrischen Knochenstimulation bei der Wirbelsäulenfusion. J Am Acad Orthop Surg. 2003;11(2):81-88.In:Simmons JW. Behandlung der fehlgeschlagenen posterioren lumbalen Interkörperfusion (PLIF) der Wirbelsäule mit pulsierenden elektromagnetischen Feldern. Clin Orthop Relat Res. 1985;(193):127-132.
- Simmons JW Jr, Mooney V, Thacker I. Pseudarthrose nach Lendenwirbelsäulenfusion: nichtoperative Bergung mit gepulsten elektromagnetischen Feldern. Bin J Orthop. 2004;33(1):27-30.
- Simmonds MC, Brown JV, Erben MK, et al. Sicherheit und Wirksamkeit von rekombinantem humanem knochenmorphogenetischem Protein-2 für die Wirbelsäulenfusion: eine Metaanalyse von Einzelteilnehmerdaten. In: Ann Intern Med. 2013;158(12):877-889.
- Fu R, Selph S, McDonagh M, et al. Wirksamkeit und Schaden von rekombinantem humanem knochenmorphogenetischem Protein-2 bei der Wirbelsäulenfusion: eine systematische Überprüfung und Metaanalyse. In: Ann Intern Med. 2013;158(12):890-902.