Dipôles
Pour comprendre la nature des interactions non covalentes, nous devons d’abord revenir aux liaisons covalentes et approfondir le sujet des dipôles. Beaucoup des liaisons covalentes que nous avons vues – entre deux carbones, par exemple, ou entre un carbone et un hydrogène – impliquent le partage à peu près égal des électrons entre les deux atomes de la liaison. Dans ces exemples, les deux atomes ont approximativement la même électronégativité. Rappelez-vous de votre cours de chimie générale que l’électronégativité fait référence au « pouvoir d’un atome dans une molécule d’attirer des électrons vers lui-même” (telle est la définition proposée par Linus Pauling, l’éminent chimiste américain du 20e siècle qui était principalement responsable du développement de nombreux concepts de liaison que nous avons appris).
Cependant, assez souvent en chimie organique, nous traitons des liaisons covalentes entre deux atomes avec des électronégativités différentes, et dans ces cas, le partage des électrons n’est pas égal: plus le noyau électronégatif rapproche les deux électrons. Dans la liaison carbone-oxygène d’un alcool, par exemple, les deux électrons de la liaison sigma sont plus étroitement liés à l’oxygène qu’au carbone, car l’oxygène est nettement plus électronégatif que le carbone. Il en va de même pour la liaison oxygène-hydrogène, car l’hydrogène est légèrement moins électronégatif que le carbone et beaucoup moins électronégatif que l’oxygène.
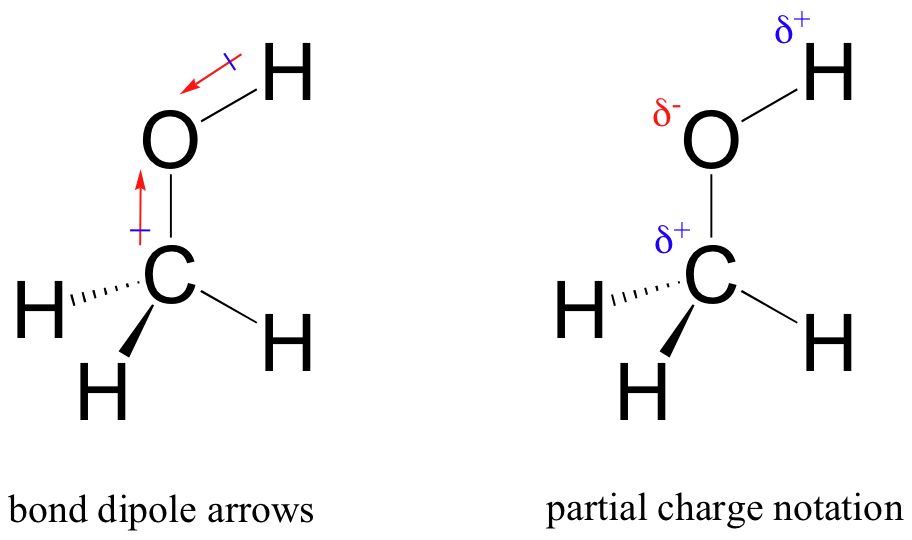
Le résultat de ce partage inégal est ce que nous appelons un dipôle de liaison, qui existe dans une liaison covalente polaire. Un dipôle de liaison a des extrémités négatives et positives, ou pôles, où la densité électronique est inférieure (le pôle positif) et supérieure (le pôle négatif). La différence de densité électronique peut être exprimée en utilisant la lettre grecque delta pour désigner la charge « positive partielle » et « négative partielle » sur les atomes. Des « flèches dipolaires », avec un signe positif sur la queue, sont également utilisées pour indiquer la direction négative (densité électronique plus élevée) du dipôle.
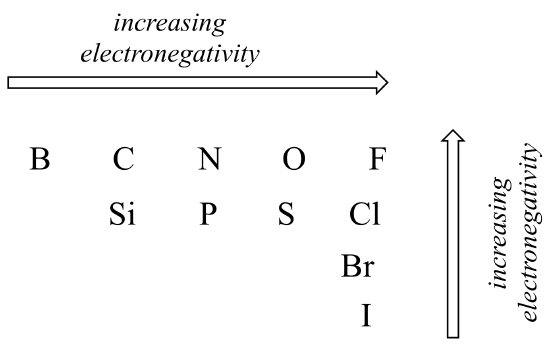
Le degré de polarité dans une liaison covalente dépend de la différence d’électronégativité entre les deux atomes. L’électronégativité est une tendance périodique: elle augmente de gauche à droite sur une ligne du tableau périodique des éléments, et augmente également à mesure que nous montons une colonne. Par conséquent, l’oxygène est plus électronégatif que l’azote, qui est à son tour plus électronégatif que le carbone. L’oxygène est également plus électronégatif que le soufre. Le fluor, dans le coin supérieur droit du tableau périodique, est le plus électronégatif des éléments. L’hydrogène est légèrement moins électronégatif que le carbone.
Tendances périodiques de l’électronégativité
Exercice 2.26
En utilisant ce que vous avez sur les orbitales atomiques, rationalisez les tendances périodiques de l’électronégativité. Pourquoi augmente-t-il de gauche à droite et diminue-t-il de haut en bas? C’est une bonne question à poser avec des camarades de classe et un instructeur ou un tuteur.
Solutions aux exercices
La plupart des molécules contiennent des liaisons covalentes polaires et non polaires. Selon l’emplacement des liaisons polaires et la géométrie de liaison, les molécules peuvent posséder une polarité nette, appelée moment dipolaire moléculaire. L’eau, comme vous vous en souvenez probablement, a un moment dipolaire qui résulte des dipôles combinés de ses deux liaisons oxygène-hydrogène. Le fluorométhane a également un moment dipolaire.
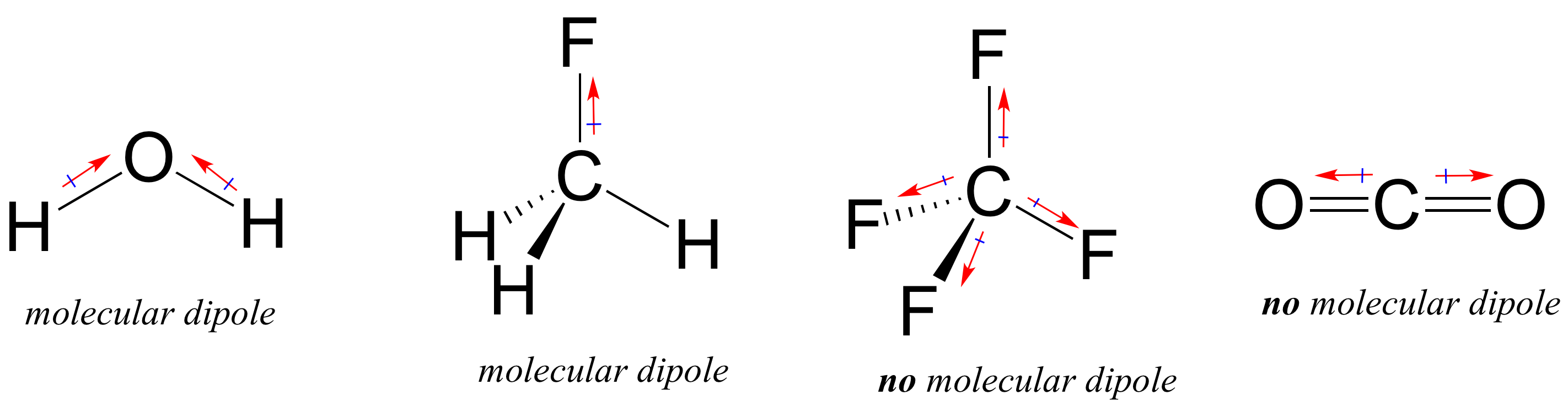
Le tétrafluorométhane, cependant, a quatre liaisons polaires qui s’enfoncent également aux quatre coins d’un tétaèdre, ce qui signifie que bien qu’il y ait quatre dipôles de liaison, il n’y a pas de moment dipolaire moléculaire global. Le dioxyde de carbone manque également d’un moment dipolaire moléculaire.
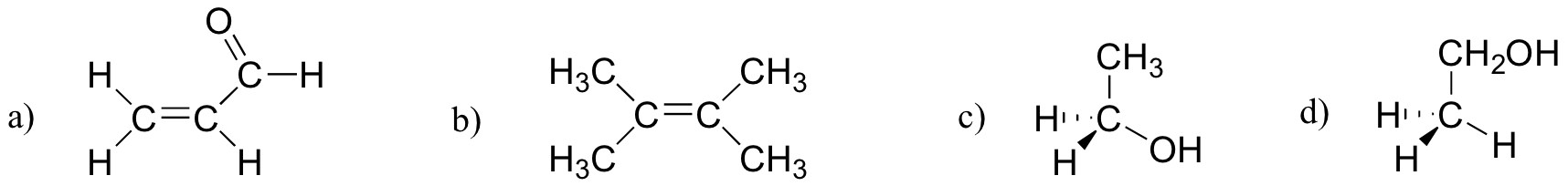
Exercice 2.27
Laquelle des molécules ci-dessous a des moments dipolaires moléculaires?
Solutions aux exercices