Faits, Résumé &Définition
- Un adduit est un produit formé par une réaction d’addition
- Les adduits ne peuvent être formés qu’à partir de réactifs ayant des liaisons multiples, tels que des alcènes et des groupes carbonyles
- Les adduits peuvent être formés à travers deux types réaction d’addition : des adduits électrophiles et nucléophiles
- se forment souvent entre les acides de Lewis et les bases de Lewis
Qu’est-ce qu’un adduit?
Un adduit est un produit formé à la fin d’une réaction d’addition. Il s’agit d’une réaction dans laquelle deux molécules ou plus réagissent et se combinent pour former un produit plus gros. Ce type de réaction ne peut se produire qu’entre des composés chimiques qui ont des liaisons multiples – des composés comme les alcènes (doubles liaisons) et les alcynes (triples liaisons). Les groupes carbonyle (C = O) et imine (C = N) peuvent également subir des réactions d’addition et former ainsi des adduits.
Comment se forment les adduits ?
Comme mentionné précédemment, les adduits sont formés par des réactions d’addition. Dans ce type de réaction, la double liaison se rompt partiellement lorsqu’une molécule réactive attaque et s’ajoute. La réaction ci-dessous montre une réaction d’addition entre l’éthène et le brome.

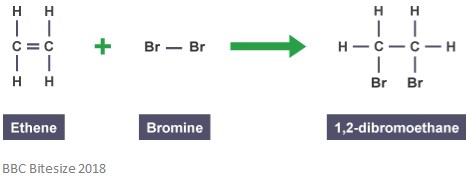
L’adduit dans cette réaction est le 1,2-dibromoéthane. C’est parce que c’est une espèce distincte qui contient tous les atomes de tous les composants.
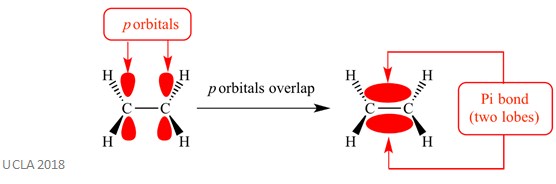
Ces réactions d’addition impliquent généralement des liaisons pi(π). Il s’agit d’un type de liaison complexe dans lequel les orbitales p sur les atomes adjacents se chevauchent – c’est ce chevauchement qui provoque la liaison pi. Cela se produit perpendiculairement à toutes les liaisons sigma entre ces deux mêmes atomes. Cette liaison pi a également deux lobes orbitaux – l’un est au-dessus du plan de la liaison sigma et l’autre est au-dessous du plan de la liaison sigma. La liaison pi est illustrée dans le diagramme ci-dessous.

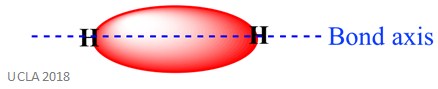
La même réaction peut également impliquer des liaisons sigma (σ). Il s’agit d’un type de forme de liaison covalente par chevauchement d’orbitales atomiques le long de l’axe de liaison – en d’autres termes, le long de la ligne qui relie les deux atomes liés. Par exemple, la liaison sigma dans un atome d’hydrogène est formée par le chevauchement de deux orbitales 1s – une de chaque atome d’hydrogène. Ceci est mieux montré dans l’image ci-dessous – la zone rouge montre la liaison sigma.

Il existe deux principaux types de réaction d’addition: l’addition électrophile et l’addition nucléophile.
Addition électrophile
Une réaction d’addition électrophile est un type de réaction dans lequel une liaison est rompue et deux nouvelles liaisons se forment. Comme discuté précédemment, le réactif doit avoir une liaison double ou triple – l’électrophile s’ajoute à une liaison pi dans ce cas. Il s’agit d’une réaction d’addition, et donc rien n’est perdu dans le processus – tous les atomes trouvés dans les molécules de réactif se trouvent également dans l’adduit.

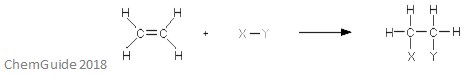
L’image ci-dessus montre la base d’une réaction d’addition électrophile. Comme vous pouvez le voir, tous les atomes des réactifs se trouvent dans l’adduit.
Addition nucléophile
Une réaction d’addition nucléophile est un type de réaction dans lequel une double liaison est rompue et deux liaisons simples se forment. Une double ou triple liaison (électrophile) déficiente en électrons réagit avec quelque chose qui est riche en électrons (nucléophile). Le nucléophile s’ajoute à une liaison pi dans ce cas. Un exemple de réaction d’addition nucléophile est illustré ci-dessous.

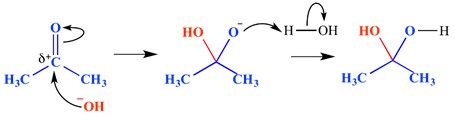
Dans cet exemple, un ion hydroxyde s’est ajouté à l’extrémité delta positive du groupe carbonyle – cela a formé une molécule intermédiaire tétraédrique oxyanionique. Le résultat final est donc l’addition d’eau à travers la liaison du groupe carbonyle pi.
Les acides de Lewis et les bases de Lewis
Des adduits sont souvent connus pour se former entre les acides de Lewis et les bases de Lewis. La molécule formée est appelée adduit acide-base de Lewis (ou complexe acide-base de Lewis). Comme les adduits ne se forment que par des réactions d’addition (c’est-à-dire sans perte simultanée d’un groupe), les réactions de Lewis-acide et de Lewis-base ne peuvent pas être du type de substitution.
Un bon exemple de ceci est la réaction entre le THF et le BH3, qui est montrée dans l’image ci-dessous. Comme vous le verrez, ces adduits acide-base de Lewis de Lewis sont représentés par des points – ceux-ci représentent des électrons.

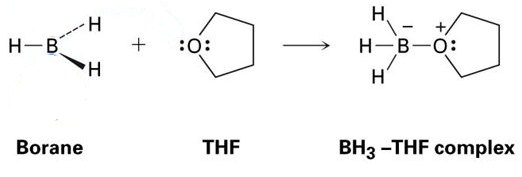
Comme vous pouvez le voir, le seul produit formé est le complexe BH3-THF, ce qui signifie qu’il s’agit d’un adduit.
Ces types de réactions peuvent également être représentés avec des flèches – ces flèches représentent le don d’électrons de la base à l’acide. La même réaction est illustrée ci-dessous, mais avec des flèches pour indiquer le don d’électrons.

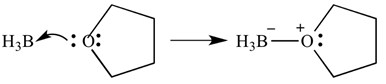
Il est important de noter ici que ces flèches ont deux « barbes » à l’extrémité pointue. Cela indique qu’une paire d’électrons a été donnée. Si un seul électron est donné, la flèche n’aura qu’un seul barde à l’extrémité pointue.
Dans ce cas, l’acide de Lewis est le borane et la base de Lewis est le THF. Comme vous pouvez le voir, la base a donné une seule paire d’électrons à l’acide pour former une liaison oxygène-bore.
Les composés incapables de former des adduits en raison de la forme des molécules sont appelés paires de Lewis frustrées.
Pour en savoir plus
http://www.chem.ucla.edu/~harding/IGOC/L/lewis_acid_base_adduct.html