Physiopathologie VIVO
Autres sujets
Aquaporines: Canaux d’eau
L’eau traverse les membranes cellulaires par deux voies: par diffusion à travers la bicouche lipidique et à travers des canaux d’eau appelés aquaporines. La caractérisation fonctionnelle de la première aquaporine a été rapportée en 1992, mais les canaux d’eau étaient soupçonnés d’exister bien avant cette époque, car la perméabilité osmotique de certains types de cellules épithéliales était beaucoup trop grande pour être expliquée par une simple diffusion à travers la membrane plasmique.
Un seul canal aquaporine-1 humain facilite le transport de l’eau à un rythme d’environ 3 milliards de molécules d’eau par seconde. Un tel transport semble être bidirectionnel, selon le gradient osmotique dominant.
Les aquaporines classiques transportent de l’eau sans soluté à travers les membranes cellulaires ; elles semblent être des canaux d’eau exclusifs et n’imprègnent pas les membranes aux ions ou autres petites molécules. Certaines aquaporines – connues sous le nom d’aquaglycéroporines – transportent de l’eau ainsi que du glycérol et quelques autres petites molécules.
La famille des aquaporines
Plus de 10 aquaporines de mammifères différents ont été identifiées à ce jour, et d’autres membres sont suspectés d’exister. Des protéines des canaux d’eau étroitement apparentées ont été isolées de plantes, d’insectes et de bactéries. L’aquaporine-1 des globules rouges humains a été la première découverte et est probablement la mieux étudiée.
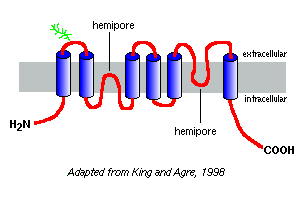
Les diagrammes d’hydrophobicité de leurs séquences d’acides aminés prédisent que les aquaporines ont six segments couvrant la membrane, comme représenté dans le modèle de l’aquaporine-1 à droite.
Sur la base d’études avec l’aquaporine-1, il semble que les aquaporines existent dans la membrane plasmique sous forme d’homotétramères. Chaque monomère d’aquaporine contient deux hémi-pores, qui se replient ensemble pour former un canal d’eau.
Différentes aquaporines ont des schémas de glycosylation différents. Dans le cas de l’aquaporine-1, le squelette peptidique est d’environ 28 kDa et les formes glycosylées vont de 40 à 60 kDa en masse. La plupart des aquaporines ont un motif de phosphorylation de la protéine kinase A dans l’une des boucles cytoplasmiques, et la phosphorylation différentielle est suspectée d’apporter une fonction régulatrice à la molécule.
Motifs d’expression de l’aquaporine
Chacune des aquaporines a un motif d’expression essentiellement unique parmi les tissus et au cours du développement. Un résumé de ces attributs et de certaines des fonctions potentielles ou connues importantes est présenté dans le tableau suivant :
| Principaux sites d’expression | ||
|---|---|---|
| Aquaporin-0 | Oeil: cellules fibreuses du cristallin | Équilibre des fluides dans le cristallin |
| Aquaporine-1 | Globules rouges | Protection osmotique |
| Rein: proximal tubule | Concentration of urine | Eye: ciliary epithelium | Production of aqueous humor | Brain: choriod plexus | Production of cerebrospinal fluid | Lung: alveolar epithelial cells | Alveolar hydration state |
| Aquaporin-2 | Kidney: collecting ducts | Mediates antidiuretic hormone activity |
| Aquaporin-3 * | Kidney: collecting ducts | Reabsorbtion of water into blood |
| Trachea: cellules épithéliales | Sécrétion d’eau dans la trachée | |
| Aquaporine-4 | Rein: conduits de collecte | Réabsorbtion de l’eau |
| Équilibre des fluides du LCR | ||
| Fonction Osmosensing ? | ||
| Poumon: épithélium bronchique | Sécrétion de liquide bronchique | |
| Aquaporine-5 | Glandes salivaires | Production de salive |
| Glandes lacrymales | Production de larmes | |
| Aquaporine-6 | Rein | Très faible perméabilité à l’eau; fonction? |
| Aquaporine-7 * | Cellules adipeuses | Transporte le glycérol hors des adipocytes |
| Aquaporine-8 | Testicules, pancréas, foie, autres | |
| Aquaporine-9* | Leucocytes | |
| * une aquaglycéroporine | ||
Il doit être clair que les aquaporines sont très largement distribuées, et aussi que les différentes les aquaporines ont différentes spécialités fonctionnellement importantes.
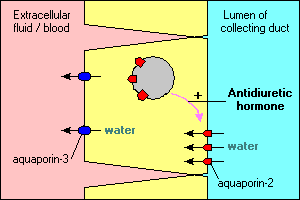
Plusieurs caractéristiques intéressantes et importantes du transport de l’eau par aquaporine sont illustrées dans les principales cellules qui tapissent les canaux de collecte dans le rein. L’eau qui s’écoule à travers ces conduits peut soit continuer et être évacuée dans l’urine, soit être réabsorbée à travers l’épithélium et réintroduite dans le sang. La réabsorption est essentiellement nulle à moins que les cellules épithéliales ne voient l’hormone antidiurétique, qui stimule fortement la réabsorption de l’eau. Les cellules du conduit collecteur expriment au moins deux aquaporines:
- L’aquaporine-2 est synthétisée mais, en l’absence d’hormone antidiurétique, réside dans un pool de vésicules membranaires dans le cytoplasme. La liaison de l’hormone antidiurétique à son récepteur dans la cellule stimule non seulement la transcription du gène aquaporine-2, mais provoque l’insertion du pool intracellulaire d’aquaporine-2 dans la membrane apicale. La cellule est maintenant capable de capter efficacement l’eau de la lumière du conduit.
- L’aquaporine-3 est exprimée de manière constitutive dans la membrane basolatérale de la cellule. Lorsque l’eau pénètre dans la cellule par les canaux aquaporine-2, elle peut rapidement sortir de la cellule par les canaux aquaporine-3 et s’écouler dans le sang.
Aquaporines et maladies
Compte tenu de l’importance du transport de l’eau dans une myriade de processus physiologiques, il est à prévoir que des lésions dans les gènes de l’aquaporine ou un dysfonctionnement acquis dans les aquaporines peuvent provoquer ou contribuer à plusieurs états pathologiques. La recherche de telles connexions est encore précoce, mais deux exemples clairs de maladie ont été identifiés comme résultant d’une carence en aquaporines:
- Des mutations dans le gène de l’aquaporine-2 provoquent un diabète insipide néphrogénique héréditaire chez l’homme.
- Des souris homozygotes pour inactiver des mutations du gène aquaporine-0 développent des cataractes congénitales.
- L’obésité chez l’adulte se développe chez les souris homozygotes pour inactiver les mutations du gène aquaporine-7, probablement en raison de l’inefficacité du transport du glycérol des réserves de triglycérides hydrolysées.
Un petit nombre de personnes ont été identifiées avec une carence sévère ou totale en aquaporine-1. Fait intéressant, ils ne semblent pas affectés cliniquement, mais n’ont pas été examinés dans des conditions de privation d’eau. Les souris avec des délétions ciblées dans l’aquaporine-1 semblent également normales et en bonne santé à moins qu’elles ne soient soumises à une restriction hydrique, auquel cas elles deviennent sévèrement hyperosmolaires.
Références et revues
- Borgnia M, Nielsen S, Engel A, Agre P: Biologie cellulaire et moléculaire des canaux d’eau d’aquaporine. Annu Rev Biochem 68:425, 1999.
- DeGroot BL, Grubmuller H: Perméation de l’eau à travers les membranes biologiques: Mécanisme et dynamique de l’aquaporine-1 et du GlpF. Sciences 294:2353, 2001.
- Hibuse T, Proc Nat Acad Sci (États-Unis) 102:10993, 2005.
- King LS, Agre P: Physiopathologie des canaux d’eau d’aquaporine. Annu Rev Physiol 58:619, 1998.
- Knepper MA, Inoue T: Regulation of aquaporin-2 water channel trafficking by vasopressin. Cellule d’opinion de Curr Biol 9:560, 1997.
- Lee MD, King LS, Agre P: La famille aquaporine des protéines des canaux d’eau en médecine clinique. Médecine 76:141, 1997.
- Preston GM, Carroll TP, Guggino WP Agre P: Apparition de canaux d’eau dans les ovocytes de Xénope exprimant la protéine CHIP28 des globules rouges. Science 256:385, 1992.
- Sasaki S, Ishibashi K, Marumo F: Aquaporine-2 et -3: Représentants de deux sous-groupes de la famille des aquaporines colocalisés dans le conduit collecteur des reins. Annu Rev Physiol 60:199, 1998.