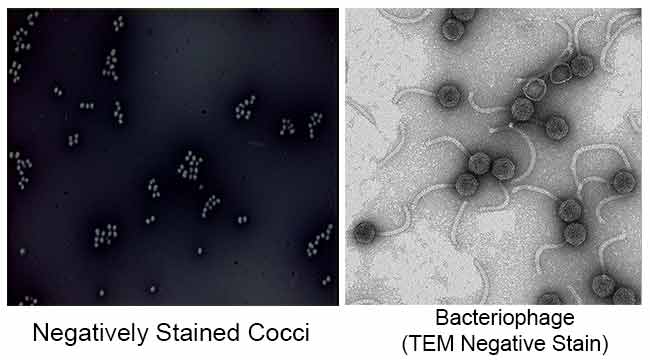
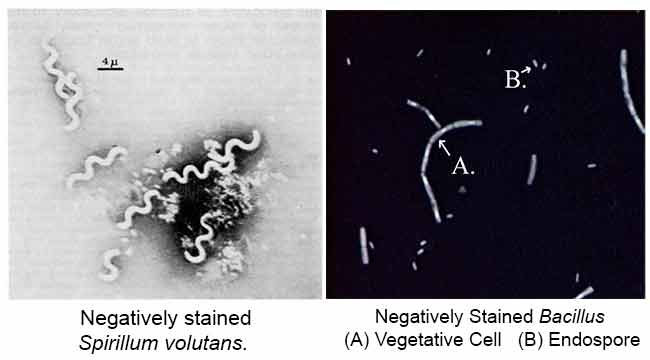
Le but principal de la coloration négative est d’étudier la forme morphologique, la taille et la disposition des cellules bactériennes difficiles à colorer. par exemple: Spirilla. Il peut également être utilisé pour colorer des cellules trop délicates pour être fixées à la chaleur.
Il est également utilisé pour préparer des échantillons biologiques pour la microscopie électronique. Il est utilisé pour visualiser les virus, les bactéries, les flagelles bactériens, les structures membranaires biologiques et les protéines ou agrégats de protéines, qui ont tous un faible pouvoir de diffusion des électrons. Il est également utilisé pour l’étude et l’identification d’agrégats lipidiques aqueux tels que les liposomes lamellaires (le), les micelles sphériques inversées (M) et les phases cylindriques HII hexagonales inversées (H) par microscopie électronique à transmission par coloration négative.
Principe de coloration négative
La coloration négative nécessite un colorant acide tel que l’Encre de Chine ou la Nigrosine.
L’encre de Chine ou Nigrosine est une tache acide. Cela signifie que la tache abandonne facilement un ion hydrogène (proton) et que le chromophore du colorant se charge négativement. Comme la surface de la plupart des cellules bactériennes est chargée négativement, la surface cellulaire repousse la tache. Le verre de la lame va tacher, mais pas les cellules bactériennes. Les bactéries apparaîtront sous forme de taches claires sur un fond sombre.
Réactifs de Coloration Négative
Encre de Chine
Nigrosine
Nigrosine 100 g /L, Formol 5 ml /L dans l’eau
Procédure de Coloration Négative
1. Placez une très petite goutte (plus qu’une boucle pleine, moins qu’une goutte en chute libre du compte-gouttes) de nigrosin près d’une extrémité d’une lame bien nettoyée et flambée.
2. Retirez une petite quantité de la culture de l’inclinaison avec une boucle d’inoculation et dispersez-la dans la goutte de tache sans étaler la goutte.

3. Utilisez une autre lame propre pour étaler la goutte de tache contenant l’organisme en utilisant la technique suivante.

4. Posez une extrémité de la lame propre au centre de la lame avec la tache. Inclinez la glissière propre vers la goutte formant un angle aigu et dessinez cette glissière vers la goutte jusqu’à ce qu’elle touche la goutte et la fasse se propager le long du bord de la glissière de l’épandeur. En maintenant un petit angle aigu entre les glissières, poussez la glissière d’écartement vers l’extrémité propre de la glissière en cours de coloration en faisant glisser la goutte derrière la glissière d’écartement et en produisant un frottis large, uniforme et mince.
 |
 |
5. Laisser sécher le frottis sans chauffer.

6. Concentrez une zone mince sous immersion dans l’huile et observez les cellules non colorées entourées de la tache grise.
Procédure de visualisation au Microscope électronique à Transmission (TEM)
- Tenir un flim à grille revêtue vers le haut dans une paire de pinces à serrage automatique.
- Faire un mélange 1:1 d’échantillon et de tache négative (par exemple. 2% d’acétate d’uranyle ou 2% de phosphotungstate de sodium ou de potassium, pH 7,4). Ajoutez 5µl à la grille. Les particules plus petites s’adsorbent à la surface de la grille plus rapidement que les particules plus grosses.
Alternativement, l’échantillon mélangé au fixateur peut être ajouté à la grille avant une coloration négative ultérieure. - Incuber pendant 30 à 90 secondes puis retirer l’excès de liquide avec le bord déchiré d’un morceau de papier filtre.
- Sécher à l’air et examiner dans le TEM.
Résultats de la Coloration Négative