Generic Name: epinastine hydrochloride
Dosage Form: ophthalmic solution
Medically reviewed by Drugs.com. Last updated on June 1, 2020.
- Overview
- Side Effects
- Dosage
- Professional
- Pregnancy
- More
Indications and Usage for Epinastine HCl Ophthalmic Solution
Epinastine HCl Ophthalmic Solution 0.05% est indiqué pour la prévention des démangeaisons associées à la conjonctivite allergique.
Posologie et administration de la Solution ophtalmique d’Épinastine HCl
La posologie recommandée est d’une goutte dans chaque œil deux fois par jour.
Le traitement doit être poursuivi tout au long de la période d’exposition (c.-à-d. jusqu’à la fin de la saison pollinique ou jusqu’à la fin de l’exposition à l’allergène incriminé), même en l’absence de symptômes.
Formes posologiques et concentrations
Solution contenant 0.5 mg/mL D’épinastine HCl
Contre-indications
Aucune
Mises en garde et précautions
Contamination de la pointe et de la solution
Les patients doivent être informés d’éviter de laisser la pointe du récipient de distribution entrer en contact avec l’œil, les structures environnantes, les doigts ou toute autre surface afin d’éviter la contamination de la solution par des bactéries courantes connues pour causer des infections oculaires. Des lésions oculaires graves et une perte de vision subséquente peuvent résulter de l’utilisation de solutions contaminées.
La bouteille doit être bien fermée lorsqu’elle n’est pas utilisée.
Utilisation avec des lentilles de contact
Il est conseillé aux patients de ne pas porter de lentilles de contact si leur œil est rouge. La solution ophtalmique d’Épinastine HCl à 0,05% ne doit pas être utilisée pour traiter les irritations liées aux lentilles de contact.
Le conservateur contenu dans la Solution ophtalmique d’Épinastine HCl à 0,05%, le chlorure de benzalkonium, peut être absorbé par des lentilles de contact souples. Les lentilles de contact doivent être retirées avant l’instillation de la Solution ophtalmique d’Épinastine HCl à 0,05% et peuvent être réinsérées 10 minutes après son administration.
Utilisation Ophtalmique topique Uniquement
Solution Ophtalmique d’Épinastine HCl 0.05% est destiné à un usage ophtalmique topique uniquement et non pour injection ou administration orale.
Effets indésirables
Expérience des études cliniques
Étant donné que les études cliniques sont menées dans des conditions très variables, les taux d’effets indésirables observés dans les études cliniques d’un médicament ne peuvent pas être directement comparés aux taux observés dans les études cliniques d’un autre médicament et peuvent ne pas refléter les taux observés en pratique.
Les effets indésirables oculaires les plus fréquemment rapportés chez environ 1 à 10 % des patients étaient une sensation de brûlure oculaire, une folliculose, une hyperémie et un prurit.
Les effets indésirables non oculaires les plus fréquemment rapportés étaient une infection (symptômes du rhume et infections des voies respiratoires supérieures), observée chez environ 10% des patients, et des maux de tête, une rhinite, une sinusite, une augmentation de la toux et une pharyngite, observés chez environ 1 à 3% des patients.
Certaines de ces réactions étaient similaires à la maladie sous-jacente étudiée.
Expérience post-commercialisation
Les réactions suivantes ont été identifiées lors de l’utilisation post-commercialisation de la Solution ophtalmique d’Épinastine HCl à 0,05% en pratique clinique. Étant donné qu’ils sont déclarés volontairement à partir d’une population de taille inconnue, il n’est pas possible d’estimer leur fréquence. Les réactions, qui ont été choisies pour l’inclusion en raison soit de leur gravité, de leur fréquence de signalement, d’un lien de causalité possible avec la solution ophtalmique d’Épinastine HCl à 0,05%, soit d’une combinaison de ces facteurs, comprennent: larmoiement augmenté.
UTILISATION DANS DES POPULATIONS SPÉCIFIQUES
Grossesse
Effets tératogènes
Grossesse Catégorie C
Dans une étude sur le développement embryofétal chez des rats gravides, une toxicité maternelle sans effet embryofétal a été observée à une dose orale d’environ 150 000 fois la dose oculaire maximale recommandée chez l’homme (MROHD) de 0,0014 mg/kg/jour en mg/kg. Des résorptions totales et des avortements ont été observés dans une étude embryofétale chez des lapines gravides à une dose orale d’environ 55 000 fois la MROHD. Dans les deux études, aucun effet tératogène induit par le médicament n’a été noté.
L’épinastine a réduit le gain de poids corporel des petits après une dose orale à des rats gravides qui était d’environ 90 000 fois la MROHD.
Il n’existe cependant pas d’études adéquates et bien contrôlées chez la femme enceinte. Étant donné que les études sur la reproduction animale ne sont pas toujours prédictives de la réponse humaine, la solution ophtalmique d’Épinastine HCl à 0,05% ne doit être utilisée pendant la grossesse que si le bénéfice potentiel justifie le risque potentiel pour le fœtus.
Mères allaitantes
Une étude chez des rats allaitants a révélé une excrétion d’épinastine dans le lait maternel. On ne sait pas si ce médicament est excrété dans le lait maternel. Étant donné que de nombreux médicaments sont excrétés dans le lait maternel, des précautions doivent être prises lorsque la solution ophtalmique d’Épinastine HCl à 0,05% est administrée à une femme qui allaite.
Utilisation pédiatrique
L’innocuité et l’efficacité chez les patients pédiatriques de moins de 2 ans n’ont pas été établies.
Utilisation gériatrique
Aucune différence globale d’innocuité ou d’efficacité n’a été observée entre les patients âgés et les patients plus jeunes.
Solution ophtalmique d’Épinastine HCl Description
Solution Ophtalmique d’Épinastine HCl 0.05% is a clear, colorless, sterile isotonic solution containing epinastine HCl, an antihistamine and an inhibitor of histamine release from the mast cell for topical administration to the eyes.
Epinastine HCl is represented by the following structural formula:
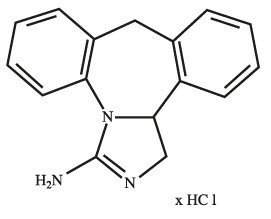
C16H15N3HCl Mol. Wt. 285.78
Chemical Name:
3-Amino-9,13b-dihydro-1H-dibenzimidazoazepine hydrochloride
Each mL contains: Active: Epinastine HCl 0.05% (0.5 mg/mL) equivalent to epinastine 0.044% (0.44 mg/mL); Preservative: Benzalkonium chloride 0.01%; Inactives: Édétate disodique, dihydraté; eau purifiée; chlorure de sodium; phosphate de sodium, monobasique, anhydre; et hydroxyde de sodium et/ ou acide chlorhydrique (pour ajuster le pH).
La solution ophtalmique d’Épinastine HCl à 0,05% a un pH d’environ 7 et une plage d’osmolalité de 250 à 310 mOsm/kg.
Solution ophtalmique d’Épinastine HCl – Pharmacologie clinique
Mécanisme d’action
L’épinastine est un antagoniste direct des récepteurs H1 actif localement et un inhibiteur de la libération d’histamine par le mastocyte. L’épinastine est sélective pour le récepteur H1 de l’histamine et a une affinité pour le récepteur H2 de l’histamine. L’épinastine possède également une affinité pour les récepteurs α1, α2 et 5-HT2.
Pharmacocinétique
Quatorze sujets atteints de conjonctivite allergique ont reçu une goutte de solution ophtalmique d’Épinastine HCl à 0,05% dans chaque œil deux fois par jour pendant 7 jours. Le jour 7, les concentrations plasmatiques maximales moyennes d’épinastine de 0,04 ±0,014 ng /ml ont été atteintes après environ deux heures, indiquant une faible exposition systémique. Alors que ces concentrations représentaient une augmentation par rapport à celles observées après une dose unique, les valeurs de l’aire de jour 1 et de jour 7 sous la courbe (ASC) étaient inchangées, ce qui indique qu’il n’y a pas d’augmentation de l’absorption systémique avec des dosages multiples. L’épinastine est liée à 64% aux protéines plasmatiques. La clairance systémique totale est d’environ 56 L/h et la demi-vie terminale d’élimination plasmatique est d’environ 12 heures. L’épinastine est principalement excrétée sous forme inchangée. Environ 55% d’une dose intraveineuse est récupérée inchangée dans l’urine avec environ 30% dans les fèces. Moins de 10% est métabolisé. L’élimination rénale se fait principalement par sécrétion tubulaire active.
Toxicologie non clinique
Carcinogenèse, Mutagénèse, Altération de la fertilité
Dans des études de cancérogénicité alimentaire sur 18 mois ou 2 ans chez la souris ou le rat, respectivement, l’épinastine n’était pas cancérogène à des doses allant jusqu’à 40 mg/kg.
L’épinastine dans les lots nouvellement synthétisés était négative pour la mutagénicité dans le test Ames/Salmonella et dans le test d’aberration chromosomique in vitro utilisant des lymphocytes humains. Des résultats positifs ont été observés avec les premiers lots d’épinastine dans deux études d’aberration chromosomique in vitro menées dans les années 1980 avec des lymphocytes périphériques humains et avec des cellules V79, respectivement. L’épinastine s’est révélée négative dans les études de clastogénicité in vivo, y compris le test du micronoyau de souris et le test de l’aberration chromosomique chez les hamsters chinois. L’épinastine a également été négative dans le test de transformation cellulaire utilisant des cellules embryonnaires de hamster syrien, le test de mutation ponctuelle de cellules de mammifères V79 / HGPRT et le test de synthèse d’ADN in vivo / in vitro non programmée utilisant des hépatocytes primaires de rat.
L’épinastine n’a eu aucun effet sur la fertilité des rats mâles. Une diminution de la fertilité chez les rats femelles a été observée à une dose orale allant jusqu’à environ 90 000 fois la MROHD.
Études cliniques
L’épinastine HCl 0,05% s’est avérée significativement supérieure au véhicule pour améliorer les démangeaisons oculaires chez les patients atteints de conjonctivite allergique dans des études cliniques utilisant deux modèles différents: (1) défi antigénique conjonctival (CAC) où les patients ont été dosés puis ont reçu un antigène instillé dans le fornix conjonctival inférieur; et (2) études environnementales sur le terrain où les patients ont été dosés et évalués pendant la saison des allergies dans leur habitat naturel. Les résultats ont démontré un début d’action rapide pour l’épinastine HCl 0,05% dans les 3 à 5 minutes suivant la contestation de l’antigène conjonctival. La durée de l’effet s’est avérée être de 8 heures, ce qui rend un régime deux fois par jour approprié. Ce schéma posologique s’est avéré sûr et efficace jusqu’à 8 semaines, sans signe de tachyphylaxie.
Comment Fourni / Stockage et manipulation
Solution ophtalmique d’Épinastine HCl 0.05% est fourni stérile dans des bouteilles en plastique LDPE blanc opaque avec embouts compte-gouttes et bouchons en polypropylène (PP) blanc comme suit:
| 5 mL dans un flacon de 10 mL | NDC 51991-836-75 |
Stockage: Conserver à 20 °-25 ° C (68 °-77 ° F). Gardez la bouteille bien fermée et hors de la portée des enfants.
Information sur le conseil du patient
Stérilité de la pointe du compte-gouttes
Il est conseillé aux patients de ne pas toucher la pointe du compte-gouttes à une surface quelconque, car cela pourrait contaminer le contenu (voir MISES en GARDE ET PRÉCAUTIONS, 5.1).
Utilisation concomitante de lentilles de contact
Il est conseillé aux patients de ne pas porter de lentilles de contact si leur œil est rouge. Les patients doivent être informés que la solution ophtalmique d’Épinastine HCl à 0,05% ne doit pas être utilisée pour traiter l’irritation liée aux lentilles de contact. Les patients doivent également être invités à retirer les lentilles de contact avant l’instillation de la solution ophtalmique d’Épinastine HCl à 0,05%.
Le conservateur contenu dans la Solution ophtalmique d’Épinastine HCl à 0,05%, le chlorure de benzalkonium, peut être absorbé par des lentilles de contact souples. Les lentilles peuvent être réinsérées 10 minutes après l’administration d’Épinastine HCl Solution ophtalmique 0,05%
Utilisation ophtalmique topique Uniquement
Pour administration ophtalmique topique uniquement.
Rx uniquement
Distribué par:
Breckenridge Pharmaceutical, Inc.
Berlin, CT 06037
Fabriqué par:
PrimaPharma, Inc.
San Diego, CA 92121
Rev: 04/2020
2323 04/20
PRINCIPAL DISPLAY PANEL – 5 mL Bottle Carton
NDC 51991-836-75
Epinastine HCl
Ophthalmic
Solution,
0.05%
FOR USE IN THE
EYES ONLY
sterile
Rx Only
5 mL sterile
breckenridge
A Towa
Company

| EPINASTINE HYDROCHLORIDE epinastine hydrochloride solution/ drops |
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
Labeler – Breckenridge Pharmaceutical, Inc. (150554335)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| PrimaPharma, Inc. | 079699106 | MANUFACTURE(51991-836) | |
En savoir plus sur l’épinastine ophtalmique
- Effets secondaires
- Pendant la grossesse ou l’allaitement
- Informations posologiques
- Prix &Coupons
- En anglais
- 3 Avis
- Classe de médicament: antihistaminiques ophtalmiques et décongestionnants
Ressources pour les consommateurs
- Informations sur le patient
- Epinastine Ophtalmique (Lecture avancée)
Ressources professionnelles
- Informations sur la prescription
- Épinastine (Conseils professionnels aux patients)
Autres marques Elestat
Guides de traitement connexes
- Conjonctivite allergique
Avertissement médical