Comme pour l’isolement de l’ADN, les scientifiques s’appuient généralement sur des kits d’isolement de l’ARN pour leur faciliter la vie. Récemment, nous avons publié un blog sur la purification de l’ADN sans kit qui décrivait plusieurs raisons pour lesquelles faire quelque chose sans kit présente des avantages: moins de déchets plastiques, moins de dépenses et moins de se retrouver avec un tas de solutions aléatoires lorsque toutes les colonnes de spin sont épuisées. Dans cet article, nous couvrons les bases de l’isolement de l’ARN sans kit.
Conseils pour travailler avec l’ARN (que vous utilisiez un kit ou non)
Bien qu’il va sans dire qu’il faut faire attention à tout type de purification de l’ADN ou de l’ARN pour éviter la contamination, prenez des précautions supplémentaires lors de l’extraction de l’ARN. L’ARN n’est intrinsèquement pas aussi stable que l’ADN – il est monocaténaire et ses groupes ribose sont sensibles à l’hydrolyse et à la dégradation thermique. De plus, les RNases, ou enzymes qui dégradent l’ARN, sont des protéines particulièrement robustes qui se trouvent dans et sur tout, y compris votre peau. Voici quelques conseils généraux pour travailler avec l’ARN, même si vous utilisez un kit:
- Portez toujours des gants, car les RNases sur vos mains peuvent dégrader l’ARN.
- Gardez une zone de travail propre, ce qui peut inclure la pulvérisation d’un produit sur votre banc pour éliminer les RNases telles que RNaseZAP.
- Lors de la récolte de tissus, de cellules, de plantes, de champignons ou de bactéries, gardez les échantillons au froid et travaillez rapidement pour atténuer la dégradation de l’ARN.
- Assurez-vous d’utiliser de l’eau traitée au DEPC ou sans RNase. Si vous utilisez de l’eau traitée au DEPC, autoclave l’eau pour inactiver le DEPC.
- Assurez-vous que les articles en plastique ou en verre utilisés sont exempts de RNase. La vaisselle en plastique sans RNase est facilement disponible auprès de fournisseurs scientifiques et la verrerie doit être traitée avec une solution de DEPC pendant 1 heure et autoclavée pour éliminer le DEPC résiduel. Alternativement, la verrerie peut être cuite à 180 ° C pendant au moins 4 heures.
- Si vos échantillons d’ARN finaux sont remis en suspension dans de l’eau ou du tampon TE, conservez-les dans un congélateur à -80 ° C pour éviter la dégradation de l’ARN. Ils se dégraderont dans un congélateur à -20°C.
Les méthodes d’extraction de l’ARN ont évolué vers un protocole simple encore utilisé aujourd’hui
Il existe de nombreuses méthodes alternatives pour isoler l’ADN sans kit. Cependant, ce n’est pas le cas pour l’extraction et la purification de l’ARN. Il y a une méthode simple qui fonctionne, et des variations à cette méthode. Un obstacle majeur au développement de protocoles pour isoler l’ARN était que les RNases se trouvent généralement dans les cellules, et sans quelque chose pour bloquer l’activité des RNASES lors de la lyse cellulaire, l’ARN est dégradé. Pour isoler efficacement l’ARN intact, un dénaturant protéique rapide et puissant serait nécessaire – quelque chose qui décomposerait les RNases avant que les RNases aient une chance de décomposer l’ARN lors de la lyse cellulaire.
À la fin des années 1970, Chirgwin et ses collègues ont montré qu’un puissant dénaturant protéique, le thiocyanate de guanidinium, faisait exactement cela (Chirgwin et al., 1979). Ils ont développé un protocole destiné à isoler l’ARN des taches de rat dans lequel ils ont homogénéisé les taches dans une solution de thiocyanate de guanidinium et ont filé l’homogénéat pour éliminer la matière insoluble. Ensuite, l’homogénéat a été chargé sur des gradients de chlorure de césium et ultracentrifugé pendant 20 heures maximum pour séparer l’ARN intact de l’ADN et des protéines. Bien que très efficace pour isoler l’ARN total, cette méthode nécessite beaucoup de temps et, selon le nombre d’échantillons que vous pouvez avoir, l’accès à un ou plusieurs ultracentrifuges volumineux et coûteux.
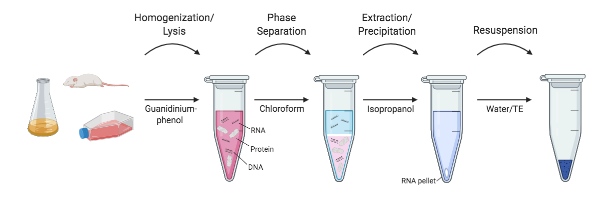
Figure 1: Aperçu des différentes étapes de l’extraction de l’ARN.
Des chercheurs des NIH au milieu des années 1980 ont entrepris de développer un protocole qui a complètement ignoré l’ultracentrifugation. Chomczynski et Sacchi ont montré que l’ARN pouvait être efficacement séparé de l’ADN et des protéines par un protocole d’extraction simple avec du thiocyanate de guanidinium -phénol-chloroforme. Dans cette méthode, les échantillons sont encore homogénéisés et lysés dans une solution de thiocyanate de guanidinium. Cependant, au lieu de séparer l’ARN en utilisant des gradients de chlorure de césium, du phénol saturé en eau, de l’acétate de sodium et du chloroforme sont ajoutés à l’homogénéat et secoués. Après une centrifugation rapide (pas d’ultracentrifugation !), les couches de phénol et de chloroforme se séparent et l’ARN est retenu dans la couche aqueuse supérieure, tandis que l’ADN et d’autres protéines sont retenus dans l’interphase et la couche organique inférieure. La couche aqueuse supérieure est extraite et l’ARN peut alors être précipité à l’isopropanol. Cette méthode a réduit le temps nécessaire pour isoler l’ARN de plus de 20 heures à environ 4 heures, et les variations de cette méthode sans kit sont encore largement utilisées aujourd’hui (Chomcynski et Sacchi, 2006).
Consultez notre protocole d’extraction d’ARN!
Rendant le protocole simple encore plus infaillible (toujours sans kit !)
Comme mentionné ci-dessus, travailler avec l’ARN nécessite de garder vos échantillons au froid jusqu’à homogénéisation et lyse cellulaire. Cela peut être difficile en fonction de votre situation de laboratoire ou de votre méthode de collecte de tissus, de sorte que les sociétés de biotechnologie ont commercialisé plusieurs produits qui aident à rationaliser davantage ce processus et / ou à stabiliser l’ARN lors de la collecte et de l’homogénéisation des tissus. Le plus connu de ces produits est le TRIzol® (également appelé TRI Reagent®, RNAzol®, QIAzol® et vendu par de nombreuses sociétés différentes). TRIzol® est une solution tout-en-un acide-guanidinium-phénol qui combine la solution d’homogénéisation et l’ajout de phénol du protocole original sans kit en une seule étape. Après homogénéisation dans le TRIzol®, l’insoluble est éliminé par centrifugation et le surnageant est extrait au chloroforme comme dans la méthode sans kit ci-dessus.
Les chercheurs ont également développé des moyens de « stabiliser » l’ARN dans les tissus avant la lyse cellulaire. Ces produits, à savoir RNAlater® de Thermo et RNAProtect® de Qiagen, sont des solutions à base de sulfate d’ammonium qui inhibent l’activité de la RNase dans les cellules ou les tissus – ils ne stabilisent pas chimiquement les molécules d’ARN (Allewell et Sarma, 1974). En outre, ThermoFisher fournit un protocole sur la façon d’intégrer RNAlater® à l’utilisation de solutions stabilisantes au TRIzol® et au sulfate d’ammonium pouvant être fabriqué en interne.
Un problème courant avec les méthodes d’extraction d’ARN sans kit est le transfert d’ADN qui peut potentiellement compliquer les résultats d’une application en aval telle que la PCR quantitative pour évaluer l’expression des gènes. Il y a plusieurs choses que les chercheurs peuvent faire pour lutter contre ce problème. Tout d’abord, soyez attentif à vos extractions – si vous avez besoin d’ARN vraiment propre, il est important de vous assurer que lors de l’extraction, ne prenez que la couche aqueuse pour éviter le transfert d’ADN de la couche organique inférieure. Une autre astuce consiste à précipiter l’ARN à l’aide de chlorure de lithium. Les solutions LiCl précipitent sélectivement l’ARN, mais pas l’ADN et les protéines. Enfin, l’utilisation d’une DNase (il existe plusieurs produits enzymatiques DNase sur le marché) sur votre échantillon d’ARN remis en suspension aidera à s’assurer que la contamination de l’ADN n’est pas un problème.

Chirgwin JM, Przybyla AE, MacDonald RJ, Rutter WJ (1979) Isolement de l’acide ribonucléique biologiquement actif à partir de sources enrichies en ribonucléase. Biochimie 18:5294-5299. https://doi.org/10.1021/bi00591a005
Chomczynski P, Sacchi N (2006) The single-step method of RNA isolation by acid guanidinium thiocyanate–phenol–chloroform extraction: twenty-something years on. Nature Protocols 1:581–585. https://doi.org/10.1038/nprot.2006.83