Monsieur,
Les carcinomes épidermoïdes (CSC) de la peau sont des tumeurs cutanées malignes fréquentes, avec une incidence de 30 pour 100 000 habitants par an en Europe occidentale. Dans les climats plus ensoleillés, ils sont encore plus fréquents. Le CSC se développe généralement à partir de kératoses actiniques. En plus de la lumière du soleil, d’autres facteurs prédisposants comprennent les rayonnements ionisants, l’inflammation chronique avec cicatrisation, les infections virales et l’immunosuppression. Les patients transplantés d’organes ont un risque nettement accru, peut-être 200 fois plus élevé, de développer un CSC, en raison de leur traitement immunosuppresseur (1). Il en va de même pour les patients présentant une immunodéficience due à d’autres facteurs, par exemple ceux infectés par le VIH (1, 2).
RAPPORT DE CAS
Un homme de 50 ans présentait une tumeur importante à la joue gauche, qui s’était développée au cours des 3 derniers mois. La tumeur présentait une bordure surélevée et un ulcère central perforé. Il avait voyagé en Tunisie 6 mois auparavant avec beaucoup d’exposition au soleil. Bien qu’il ait une peau Fitzpatrick de type II, il n’avait jamais pratiqué la protection solaire. L’examen clinique n’a pas révélé d’autres signes de lésions actiniques; plus précisément, il n’avait pas de kératoses actiniques. Depuis son séjour en Tunisie, le patient souffrait également d’une toux sèche chronique. Ses ganglions lymphatiques cervicaux étaient normaux à la palpation et à l’échographie. La tomographie par résonance magnétique n’a montré aucune infiltration des structures des tissus mous adjacents. En raison de la croissance rapide de la tumeur et de son aspect macroscopique, nous avons suspecté un kératoacanthome. L’examen histologique a révélé un CSC bien différencié mais ulcéré. L’analyse cytométrique en flux des lymphocytes T périphériques a révélé un déséquilibre, avec seulement 5 cellules CD4+/CD3+ et 226 cellules CD8+ /CD3+ (rapport 0,02), indiquant une immunodéficience et expliquant peut-être la croissance rapide de la tumeur. Malgré des conseils approfondis sur une maladie immunosuppressive potentiellement sous-jacente, le patient a rejeté d’autres procédures de diagnostic du VIH, ainsi que des études supplémentaires pour clarifier la toux (suspicion de pneumonie à Pneumocystis jiroveci) et exclure les métastases. Il a également rejeté la ré-excision avec des marges plus larges et a quitté l’hôpital contre avis médical.

Fig. 1. La joue gauche d’un homme de 50 ans avec une grosse tumeur. (a) Aspect dorsal et (b) aspect latéral.
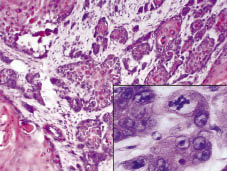
Fig. 2. L’enquête histologique a révélé une tumeur infiltrante profonde, détruisant les structures anatomiques lésionnelles. Insérer : La tumeur est composée de kératinocytes polymorphes avec plusieurs mitoses (H& E ×200, à grossissement numérique).
DISCUSSION
Le kératoacanthome (KA) a été décrit pour la première fois en 1889 par Jonathan Hutchinson comme un ulcère cratériforme du visage. Elle se présente le plus souvent comme une tumeur cutanée à croissance rapide sur les zones exposées au soleil (3). Les hommes sont touchés environ 3 fois plus souvent que les femmes. La distribution ajustée selon l’âge montre qu’il est le plus fréquent chez les personnes d’âge moyen et qu’il n’augmente pas chez les personnes âgées (contrairement au carcinome basocellulaire et au CSC) (4). Alors que les CSC se développent à partir de l’épithélium de surface, les KAS sont dérivés de la paroi du follicule pileux juste au-dessus de l’endroit où pénètre le canal sébacé. Ils constituent une entité distincte avec des caractéristiques cliniques et histologiques spécifiques (5). La tendance à la régression spontanée et le degré important de kératinisation sont les caractéristiques les plus frappantes, ainsi que l’architecture symétrique typique de la tumeur (6).
La nosologie et la classification exactes du KA font l’objet de débats. Certains auteurs considèrent la KA comme une tumeur cutanée bénigne qui est le prototype des tumeurs « pseudomalignes” de la peau, tandis que d’autres soutiennent qu’il s’agit d’une tumeur maligne – une variante particulière du CSC – et qu’elle doit donc être traitée comme le CSC (7-9). Les difficultés de diagnostic sont particulièrement vraies pour les variantes destructrices et persistantes du KA, telles que le KA géant ou le KA mutilant. Cliniquement, le KA se différencie du SCC par son histoire de croissance rapide et sa forme volcanique. Cependant, dans le cas décrit ici, un grand CSC a également montré une croissance très rapide, peut-être à cause de l’infection par le VIH. Parfois, les lésions considérées comme des KAs doivent être reclassées en SCCs sur la base de leur évolution clinique ultérieure. En plus d’un diagnostic erroné, d’autres explications sont la combinaison de KA et de CSC ainsi que la transformation de KA en CSC. De plus, certains KAS peuvent être des variantes bien différenciées des CSC, comme proposé par Ackerman (10-12).
En raison des difficultés de distinction entre KA et CSC, le traitement de choix pour tous les types de KAs reste l’excision chirurgicale avec vérification histopathologique du diagnostic (8-10). Si la chirurgie est impossible, des rayonnements ionisants peuvent être envisagés. Plusieurs autres options thérapeutiques, telles que le 5-fluorouracile topique, les injections intra-lésionnelles d’interféron alpha, de méthotrexate ou de bléomycine et les rétinoïdes administrés par voie systémique, se sont révélées efficaces dans des cas individuels, mais il n’existe aucun essai clinique contrôlé démontrant l’efficacité de ces traitements (1, 4, 5).
Certains CSC peuvent se développer rapidement, imitant un KA, comme dans le cas décrit ici. La raison de la croissance rapide du KAs n’est pas claire; plusieurs hypothèses ont été proposées, notamment l’immunosuppression et l’exposition à un ensoleillement excessif. Les KAS, en particulier ceux qui ne peuvent pas être clairement distingués du CSC, doivent être traités par une excision chirurgicale étendue, car ils peuvent avoir un pronostic défavorable avec un développement précoce de métastases.
1. Sterry W, Stockfleth E. Maligne tumeur épithéliale. Dans: Braun-Falco O, Plewig G, Wolff HH, Burgdorf WH, Landthaler M, éditeurs. Dermatologie et Vénérologie. 5e éd. Heidelberg : Springer, 2005 : p. 1267-1276.
2. Nguyen P, Vin-Christian K, Ming ME, Berger T. Carcinomes épidermoïdes agressifs chez les personnes infectées par le virus de l’immunodéficience humaine. Arch Dermatol 2002; 138: 758–763.
3. Rinker MH, Fenske NA, Scalf LA, Verre LF. Variantes histologiques du carcinome épidermoïde de la peau. Lutte contre le cancer 2001; 8:354-363.
4. Mac Kie RM, Quinn AG. Cancer de la peau non mélanome et tumeurs cutanées épidermiques. Dans: Burns T, Breathnack S, Cox N, Griffiths C, éditeurs. Manuel de dermatologie de Rook. 7e éd. Il s’agit de la première édition de la série.
5. Kurschat P, Hess S, Hunzelmann N, Scharffetter-Kochanek K. Keratoacanthoma centrifugum marginatum accompagné d’une réaction granulomateuse étendue de corps étrangers. Dermatol en ligne J 2005; 11:16.
6. Bayer-Garner IB, Ivan D, Schwartz MR, Tschen JA. L’immunopathologie de la régression dans la kératose lichénoïde bénigne, le kératoacanthome et le naevus halo. Clin Med Res 2004; 2:89-97.
7. Cribier B, Asch P, Grosshans E. Différenciation du carcinome épidermoïde du kératoacanthome à l’aide de critères histopathologiques. Est-ce possible? Une étude de 296 cas. Dermatologie 1999; 199: 208-212.
8. Beham A, Regauer S, Soyer HP, Beham-Schmid C. Keratoacanthoma: une variante cliniquement distincte du carcinome épidermoïde bien différencié. Adv Anat Pathol 199; 5:269-280.
9. Warner DM, Fleurs F, Ramos-Caro FA. Kératoacanthome solitaire (carcinome épidermoïde): prise en charge chirurgicale. Int J Dermatol 1995; 34:17-19.
10. Hodak E, Jones RE, Ackerman AB. Le kératoacanthome solitaire est un carcinome épidermoïde: trois exemples de métastases. Am J Dermatopathol 1993; 15:332-342.
11. Sanchez YE, Simon P, Requena L, Ambrojo P, de Eusebio E. kératoacanthome solitaire: une prolifération auto-cicatrisante qui devient fréquemment maligne. Am J Dermatopathol 2000; 22:305-310.
12. Lawrence N, Reed RJ. kératoacanthome actinique. Spéculations sur la nature de la lésion et le rôle de l’immunité cellulaire dans son évolution. Am J Dermatopathol 1990; 12:517-533.