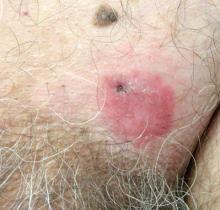
Un homme de 70 ans présentait une plaque squameuse érythémateuse non prurigineuse dans la région suprapubique gauche d’une durée de 6 mois qui n’avait pas répondu à la crème de terbinafine 1% après 1 mois de traitement de tinea cruris suspecté . Ses antécédents médicaux étaient remarquables pour l’hypertension, l’hyperlipidémie, la maladie pulmonaire obstructive chronique, l’hyperplasie bénigne de la prostate, un anévrisme de l’aorte abdominale, une dépendance à l’alcool, un trouble de l’usage du tabac et une perte de poids involontaire de 15 lb au cours de la dernière année.
Le diagnostic: Maladie de Paget extramammaire
Une biopsie de la plaque a révélé une prolifération intraépidermique de grandes cellules avec un cytoplasme clair abondant et de gros noyaux vésiculaires répartis dans tout l’épiderme (Figure 1). Les cellules néoplasiques colorées sont positives pour les taches périodiques de Schiff acide (Figure 2) et de CK7 (figure 3). Le panel de chimie et de fonction hépatique, l’analyse d’urine, les taux d’antigènes carcinoembryoniques et les taux d’antigènes spécifiques de la prostate se situaient dans la plage de référence. Une numération globulaire complète a révélé une anémie mégaloblastique légère. La tomodensitométrie subséquente de la poitrine, de l’abdomen et du bassin a révélé un anévrisme de l’aorte abdominale et une hypertrophie de la prostate sans aucune preuve de tumeurs malignes potentielles. La coloscopie a révélé plusieurs polypes hyperplasiques et un adénome tubulaire. La cystoscopie était normale, sauf pour des signes d’hypertrophie de la prostate. La cytologie urinaire était banale. Le patient a été référé pour une excision de la lésion par chirurgie micrographique de Mohs. Un suivi a été recommandé tous les 3 mois pendant les 2 premières années suivant la chirurgie et tous les 6 mois par la suite pour surveiller les récidives ou les néoplasmes secondaires.
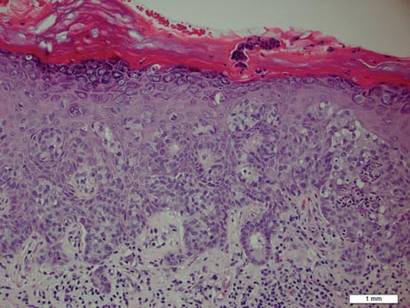
Figure 1. Prolifération intraépidermique de grandes cellules avec un cytoplasme clair abondant et de gros noyaux vésiculaires répartis dans tout l’épiderme sous forme de cellules individuelles et d’agrégats de cellules de taille variable (H & E, grossissement original ×200). (La barre de référence indique 1 mm.)
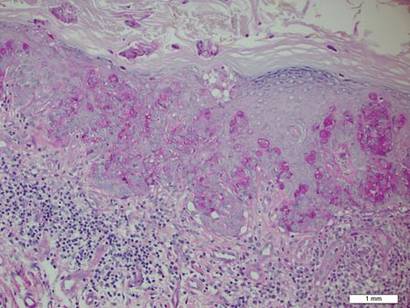
Figure 2. Le cytoplasme granulaire était positif sur coloration périodique acide-Schiff (grossissement original ×200). (La barre de référence indique 1 mm.)
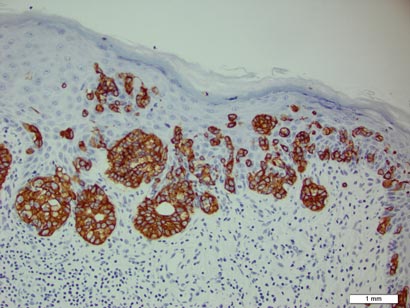
Figure 3. Les cellules de Paget néoplasiques ont été caractéristiquement positives à la coloration de CK7 (grossissement original ×200). (La barre de référence indique 1 mm.)
Sir James Paget a décrit pour la première fois la maladie mammaire de Paget du mamelon en 1874 dans son rapport sur 15 femmes présentant des éruptions cutanées du mamelon et de l’aréole et un carcinome subséquent du sein sous-jacent.1 Paget a également décrit un patient avec une éruption similaire sur le gland du pénis et Crocker2 a décrit la maladie de Paget extramammaire (EMPD) du scrotum et du pénis en 1889. La principale différence entre la maladie de Paget mammaire et l’EMPD est l’emplacement anatomique.
La maladie de Paget extramammaire est une affection rare qui affecte généralement les patients âgés de 50 à 80 ans et est plus fréquente chez les femmes et les races à peau blanche.3 La maladie de Paget extramammaire cible fréquemment des sites cutanés riches en glandes apocrines. Le site le plus souvent affecté est la vulve suivie de la peau périnéale, périanale, scrotale et pénienne. Moins fréquemment, les aisselles, les fesses, les cuisses, les paupières et les canaux auditifs externes peuvent être affectés.4
Les patients atteints d’EMPD présentent généralement des plaques érythémateuses et eczémateuses bien délimitées, non résolantes, pouvant présenter des croûtes, une desquamation, des excroissances papillomateuses, une lichénification, une ulcération ou un saignement associés. Le symptôme le plus courant est le prurit, suivi de brûlures, d’irritations, de douleurs et de sensibilité.5 Dix pour cent des patients sont asymptomatiques. L’intervalle moyen entre l’apparition des symptômes et le diagnostic est de 2 ans.5
L’histopathologie révèle des cellules de Paget néoplasiques irrégulières infiltrées de manière diffuse dans l’épiderme qui sont grandes et vacuolées avec un cytoplasme bleuâtre pâle abondant et de gros noyaux vésiculaires, qui peuvent être comprimés centralement ou latéralement. Les cellules peuvent être réparties individuellement ou en groupes sous forme de brins, de nids ou de motifs glandulaires dans l’épiderme inférieur, les crêtes de rete et les structures annexes. Une hyperkératose, une acanthose et une parakératose peuvent également être présentes. Coloration des cellules de Paget pour les marqueurs immunohistochimiques de dérivation apocrine et eccrine, y compris les cytokératines de faible poids moléculaire, la protéine liquide de la maladie kystique brute 15, la coloration périodique acide-Schiff et l’antigène carcinoembryonique.5 Perrotto et al6 ont étudié 98 échantillons de 61 patients et ont constaté que CK7 était positif dans tous les échantillons de DEMP, tandis que CK20 et la protéine liquide de la maladie kystique brute 15 étaient positifs dans de grands sous-ensembles de DEMP primaire et secondaire. Les cas d’EMPD secondaires à un adénocarcinome anorectal étaient en grande partie ERBB2 (anciennement HER2/neu) négatifs et CDX2 positifs.6
Le diagnostic d’EMPD doit être suivi d’une investigation approfondie des carcinomes sous-jacents. Lors d’un examen de 197 cas d’EMPD, 24% des patients atteints d’EMPD présentaient un carcinome apocrinien annexiel sous-jacent in situ ou invasif, associé à un taux de mortalité plus élevé que chez les patients sans cette malignité sous-jacente. De plus, 12 % des patients atteints d’EMPD présentaient une tumeur maligne interne sous-jacente associée.7 Ces tumeurs malignes peuvent inclure des carcinomes de l’urètre, de la vessie, du vagin, du col de l’utérus, de l’endomètre, de la prostate, du côlon et du rectum. L’EMPD périanale présente une fréquence plus élevée de tumeurs malignes associées que l’EMPD vulvaire.5 L’emplacement de l’EMPD est lié à l’emplacement de la malignité sous-jacente; par exemple, l’EMPD périanale est associée à des adénocarcinomes colorectaux et l’EMPD du pénis, du scrotum et de l’aine est associée à des tumeurs malignes génito-urinaires. Les investigations visant à rechercher des tumeurs malignes associées chez les patients atteints d’EMPD peuvent inclure une échographie pelvienne et / ou une imagerie par résonance magnétique, une hystéroscopie, une coloscopie, une sigmoïdoscopie, une cystoscopie, un pyélogramme intraveineux, une mammographie et / ou une radiographie thoracique.