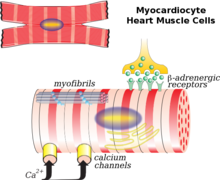
Le myocyte cardiaque est la cellule principale impliquée dans le remodelage. Les fibroblastes, le collagène, l’interstitium et les vaisseaux coronaires dans une moindre mesure jouent également un rôle. Un scénario courant de remodelage est après un infarctus du myocarde. Il y a nécrose myocardique (mort cellulaire) et amincissement disproportionné du cœur. Cette zone mince et affaiblie est incapable de supporter la pression et la charge volumique sur le cœur de la même manière que les autres tissus sains. En conséquence, il y a dilatation de la chambre résultant de la région de l’infarctus. La phase initiale de remodelage après un infarctus du myocarde entraîne une réparation de la zone nécrotique et une cicatrisation du myocarde qui peut, dans une certaine mesure, être considérée comme bénéfique car il y a une amélioration ou un maintien de la fonction VG et du débit cardiaque. Au fil du temps, cependant, à mesure que le cœur subit un remodelage continu, il devient moins elliptique et plus sphérique. La masse et le volume ventriculaires augmentent, ce qui, ensemble, affecte négativement la fonction cardiaque. Éventuellement, la fonction diastolique ou la capacité du cœur à se détendre entre les contractions peuvent être altérées, entraînant un déclin supplémentaire.
Après un infarctus du myocarde (IM), la mort des myocytes cardiaques peut être déclenchée par une nécrose, une apoptose ou une autophagie, entraînant un amincissement de la paroi cardiaque. Les myocytes cardiaques survivants s’organisent en parallèle ou en série les uns par rapport aux autres, contribuant à la dilatation ventriculaire ou à l’hypertrophie ventriculaire, en fonction de la contrainte de charge sur la paroi ventriculaire. En outre, une expression réduite de la mysoïne V1 et des canaux calciques de type L sur les myocytes cardiaques serait également à l’origine du remodelage cardiaque. Dans des conditions corporelles normales, les acides gras représentent 60 à 90% de l’apport énergétique du cœur. Après l’IM, à mesure que l’oxydation des acides gras diminue, elle entraîne une réduction de l’apport énergétique des myocytes cardiaques, une accumulation d’acides gras à des niveaux toxiques et un dysfonctionnement des mitochondries. Ces conséquences ont également conduit à l’augmentation du stress oxydatif sur le cœur, provoquant la prolifération des fibroblastes, l’activation des métalloprotéinases et l’induction de l’apoptose, ce qui sera expliqué ci-dessous. En outre, la réponse immunitaire inflammatoire après l’IM contribue également aux changements ci-dessus.
En outre, l’interstitium cardiaque constitué en grande partie de fibres de collagène de type I et de type III est également impliqué dans le remodelage cardiaque. Le collagène cardiaque est synthétisé par des fibroblastes et dégradé par des métalloprotéinases. Les fibroblastes sont activés après l’IM, ce qui entraîne une augmentation de la synthèse du collagène et une fibrose du cœur. L’augmentation de l’expression de MMP1 et MMP9 a entraîné une dégradation des fibres de collagène, puis une dilatation du cœur. Plusieurs voies de signalisation telles que l’Angiotensine II, le facteur de croissance transformant bêta (TGF-bêta) et l’endothéline 1 sont connues pour déclencher la synthèse et la dégradation des fibres de collagène dans le cœur.
D’autres facteurs tels que l’hypertension artérielle, l’activation du système sympathique qui libère de la noradrénaline, l’activation du système rénine–angiotensine qui libère de la rénine et les hormones anti-diurétiques sont des contributeurs importants du remodelage cardiaque. Cependant, on pense que le peptide natriurétique auriculaire est cardio-protecteur.