Identifiez la molécule la plus acide H
Une approche méthodique fonctionne le mieux. En termes simples, vous devez scanner la molécule pour rechercher des groupes fonctionnels acides, puis classer la réactivité de ces groupes. Le groupe fonctionnel le plus acide contient généralement le H le plus acide de la molécule entière.
« Scan and rank » semble simple, mais il cache plusieurs difficultés qui sont développées ci-dessous.
Rechercher dans une molécule des groupes fonctionnels acides connus
Les protons acides sont généralement liés à O ou N. Par conséquent, la première étape consiste à rechercher toutes les liaisons OH et NH.
Cependant, lorsque vous localisez les liaisons OH et NH, vous devrez décider si ces atomes liés doivent être regroupés dans un groupe fonctionnel avec des atomes voisins.
La SEULE méthode pratique pour identifier un groupe fonctionnel est d’en connaître déjà certains. Par exemple, si vous savez que ROH, RCO2H et RSO3H sont des groupes fonctionnels acides communs, vous n’aurez aucun mal à trouver des groupes acides dans la molécule suivante (les groupes corrects sont marqués en rouge).
Classez l’acidité OH et NH séparément
Les valeurs pKa des acides OH et NH communs couvrent de larges plages et leurs plages se chevauchent. Le classement se déroule plus rapidement si vous classez les acides OH et NH séparément, puis comparez les meilleurs candidats dans chaque catégorie.
La méthode la plus pratique pour classer les groupes acides est de connaître déjà leurs valeurs pKa caractéristiques. Si vous connaissez ces valeurs pour tous les groupes acides de votre molécule, alors le groupe avec le pKa le plus bas contient le H le plus acide.
Si vous ne vous souvenez pas des valeurs de pKa pour tous les groupes acides, quelques principes généraux peuvent vous guider.
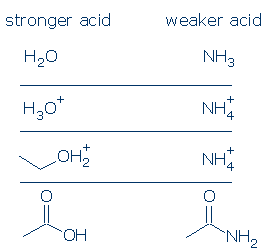
#1 Importance – les acides chargés positivement sont plus forts que les acides neutres. Les acides chargés négativement sont rarement acides. Si vous comparez les valeurs de pKa des acides OH communs, vous verrez que les acides ROH2 + (qui incluent H3O + et R2OH +) sont considérablement plus forts que les acides neutres, tels que RCO2H, PhOH et ROH. Les seuls acides neutres plus forts que le ROH2+ sont le H2SO4 et certains autres RSO3H.
La règle de charge formelle s’applique encore plus fortement aux acides NH. La différence de pKa entre H3O + et H2O est de 18 unités, tandis que la différence de pKa entre NH4 + et NH3 est un gigantesque 26 unités.
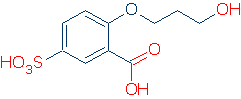
#2 Importance – recherchez les groupes activateurs, y compris RSO2, RC =O et Ph. Le graphique suivant montre comment chaque groupe d’atomes active un acide OH (les valeurs de pKa vont de 16 à -2):
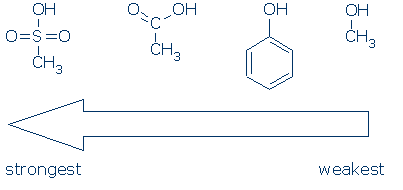
Le CH3 est considéré comme un groupe spectateur partout où il apparaît dans ces molécules. Il est apolaire et n’exerce pas d’effet inductif de champ significatif, et il est incapable de délocaliser la charge. Par conséquent, il est possible de remplacer CH3 par d’autres groupes de spectateurs (par exemple, H et autres R) sans affecter beaucoup la réactivité.
Deux points supplémentaires doivent être faits concernant l’activation des groupes.
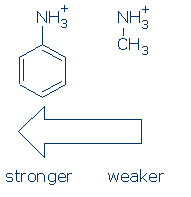
Tout d’abord, les groupes exercent un effet similaire sur les acides NH (et la séquence d’activation est la même: RSO2 >RC=O >Ph). En l’occurrence, il vous suffit d’apprendre l’effet du Ph sur le NH + pour ce cours:
Deuxièmement, les groupes d’activation doivent être liés directement au groupe OH (ou NH) pour l’activer. Les composés suivants ont des valeurs de pKa similaires car les groupes activateurs ne sont pas liés directement à OH: CH3C (= O) CH2OH, PhCH2OH et CH3CH2OH.
#3 Importance – toutes choses étant égales par ailleurs, un acide OH est plus acide qu’un acide NH. Ce principe peut être très utile s’il est utilisé correctement. Ma préoccupation est que vous compreniez ce que l’on entend par « toutes choses étant égales par ailleurs. »Cela signifie que O et N doivent avoir la même charge formelle (article 1) et doivent être liés au même groupe d’activation (article 2). Cependant, les différences dans les groupes de spectateurs n’ont pas d’importance.
Certaines comparaisons valides incluent:
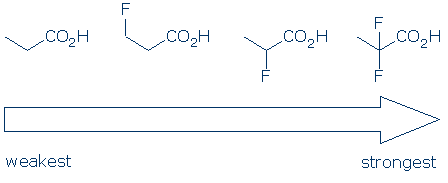
#4 Importance – dans une catégorie de groupe fonctionnel, utilisez les effets de substituants pour comparer les acides. Les substituants électronégatifs augmentent généralement l’acidité d’un groupe fonctionnel grâce à une combinaison d’effets de champ et d’inducteurs. Ces effets sont renforcés lorsque 1) le substituant est situé plus près du groupe acide et 2) il y a plusieurs substituants. Compte tenu de ces principes, nous nous attendons à ce que l’acidité de ces acides carboxyliques suive cette tendance: