Dipoli
Per comprendere la natura delle interazioni non covalenti, dobbiamo prima tornare ai legami covalenti e approfondire il tema dei dipoli. Molti dei legami covalenti che abbiamo visto –tra due carboni, per esempio, o tra un carbonio e un idrogeno-coinvolgono la condivisione approssimativamente uguale di elettroni tra i due atomi nel legame. In questi esempi, i due atomi hanno approssimativamente la stessa elettronegatività. Ricordiamo dal tuo corso di chimica generale che l’elettronegatività si riferisce al “potere di un atomo in una molecola di attrarre elettroni a se stesso” (questa è la definizione offerta da Linus Pauling, l’eminente chimico americano del 20 ° secolo che è stato il principale responsabile dello sviluppo di molti dei concetti di legame che abbiamo imparato).
Tuttavia, molto spesso in chimica organica ci occupiamo di legami covalenti tra due atomi con diverse elettronegatività, e in questi casi la condivisione di elettroni non è uguale: più il nucleo elettronegativo avvicina i due elettroni. Nel legame carbonio-ossigeno di un alcol, ad esempio, i due elettroni nel legame sigma sono tenuti più strettamente all’ossigeno che al carbonio, perché l’ossigeno è significativamente più elettronegativo del carbonio. Lo stesso vale per il legame ossigeno-idrogeno, poiché l’idrogeno è leggermente meno elettronegativo del carbonio e molto meno elettronegativo dell’ossigeno.
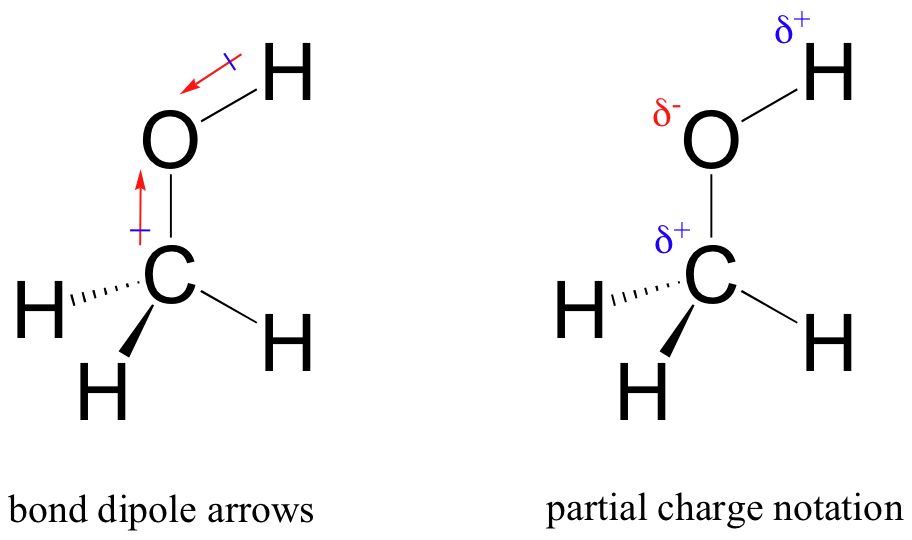
Il risultato di questa condivisione disuguale è quello che chiamiamo un dipolo di legame, che esiste in un legame covalente polare. Un dipolo di legame ha entrambe le estremità negative e positive, o poli, dove la densità elettronica è inferiore (il polo positivo) e superiore (il polo negativo). La differenza di densità elettronica può essere espressa usando la lettera greca delta per indicare la carica “parziale positiva” e “parziale negativa” sugli atomi. Le “frecce di dipolo”, con un segno positivo sulla coda, sono utilizzate anche per indicare la direzione negativa (maggiore densità elettronica) del dipolo.
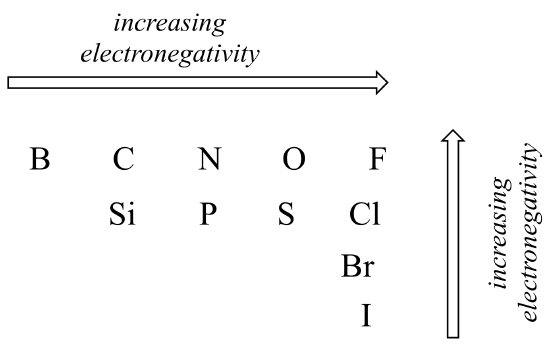
Il grado di polarità in un legame covalente dipende dalla differenza di elettronegatività tra i due atomi. L’elettronegatività è una tendenza periodica: aumenta andando da sinistra a destra attraverso una riga della tavola periodica degli elementi, e aumenta anche man mano che saliamo su una colonna. Pertanto, l’ossigeno è più elettronegativo dell’azoto, che a sua volta è più elettronegativo del carbonio. L’ossigeno è anche più elettronegativo dello zolfo. Il fluoro, nell’angolo in alto a destra della tavola periodica, è il più elettronegativo degli elementi. L’idrogeno è leggermente meno elettronegativo del carbonio.
Tendenze periodiche in elettronegatività
Esercizio 2.26
Utilizzando ciò che si circa orbitali atomici, razionalizzare le tendenze periodiche in elettronegatività. Perché aumenta da sinistra a destra e diminuisce dall’alto verso il basso? Questa è una buona domanda per parlare con i compagni di classe e un istruttore o tutor.
Soluzioni agli esercizi
La maggior parte delle molecole contiene legami covalenti polari e non polari. A seconda della posizione dei legami polari e della geometria di legame, le molecole possono possedere una polarità netta, chiamata momento di dipolo molecolare. L’acqua, come probabilmente ricorderete, ha un momento di dipolo che deriva dai dipoli combinati dei suoi due legami ossigeno-idrogeno. Il fluorometano ha anche un momento di dipolo.
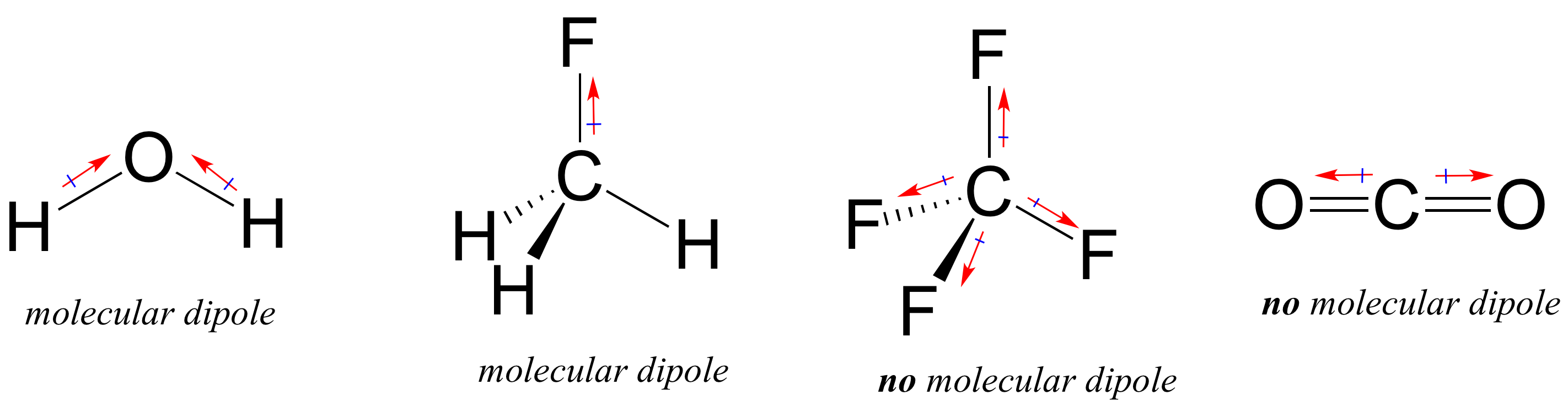
Il tetrafluorometano, tuttavia, ha quattro legami polari che si attraggono ugualmente ai quattro angoli di un tetaedro, il che significa che sebbene ci siano quattro dipoli di legame non esiste un momento di dipolo molecolare complessivo. L’anidride carbonica manca anche di un momento di dipolo molecolare.
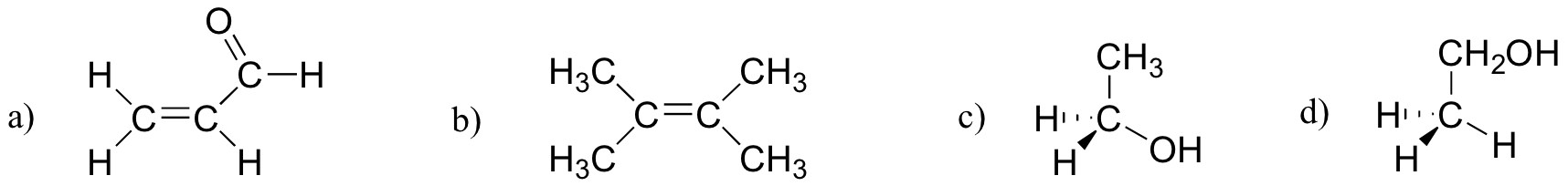
Esercizio 2.27
Quale delle molecole sottostanti ha momenti di dipolo molecolare?
Soluzioni agli esercizi