VIVO Fisiopatologia
Altri Argomenti
Acquaporine: Canali d’Acqua
l’Acqua attraversa le membrane cellulari dai due itinerari: dalla diffusione attraverso il doppio strato lipidico e l’acqua, canali chiamati acquaporine. La caratterizzazione funzionale del primo aquaporin è stata riportata nel 1992, ma i canali dell’acqua erano sospettati di esistere ben prima di quel momento, perché la permeabilità osmotica di alcuni tipi di cellule epiteliali era troppo grande per essere spiegata dalla semplice diffusione attraverso la membrana plasmatica.
Un singolo canale umano aquaporin-1 facilita il trasporto dell’acqua ad una velocità di circa 3 miliardi di molecole d’acqua al secondo. Tale trasporto sembra essere bidirezionale, in accordo con il gradiente osmotico prevalente.
Le aquaporine classiche trasportano acqua senza soluto attraverso le membrane cellulari; sembrano essere canali d’acqua esclusivi e non permeano le membrane agli ioni o ad altre piccole molecole. Alcune aquaporine-note come aquaglyceroporins-trasportano acqua più glicerolo e poche altre piccole molecole.
La famiglia di Aquaporine
Sono stati identificati fino ad oggi più di 10 diversi acquaporine di mammiferi e si sospetta che esistano altri membri. Le proteine del canale dell’acqua strettamente correlate sono state isolate da piante, insetti e batteri. Aquaporin-1 da globuli rossi umani è stato il primo ad essere scoperto ed è probabilmente il migliore studiato.
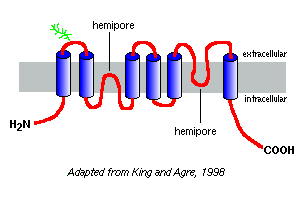
I diagrammi di idrofobicità delle loro sequenze amminoacidiche prevedono che le aquaporine abbiano sei segmenti di membrana, come illustrato nel modello di aquaporin-1 a destra.
Sulla base di studi con aquaporin-1, sembra che le aquaporine esistano nella membrana plasmatica come omotetrameri. Ogni monomero aquaporin contiene due emipori, che si piegano insieme per formare un canale d’acqua.
Diverse acquaporine hanno diversi modelli di glicosilazione. Nel caso di aquaporin-1, la spina dorsale del peptide è approssimativamente 28 kDa e le forme glicosilate variano da 40 a 60 kDa in massa. La maggior parte delle aquaporine hanno una proteina chinasi Un motivo fosforilazione in uno dei cicli citoplasmatici, e fosforilazione differenziale si sospetta empart una funzione regolatrice alla molecola.
Pattern di espressione dell’aquaporina
Ciascuna delle aquaporine ha un pattern di espressione essenzialmente unico tra i tessuti e durante lo sviluppo. Una sintesi di questi attributi, e alcune delle importanti potenzialità o funzioni conosciute è presentato nella tabella seguente:
| Principali luoghi di Espressione | ||
|---|---|---|
| Acquaporina-0 | Occhio: obiettivo celle in fibra | l’equilibrio dei Fluidi all’interno dell’obiettivo |
| Acquaporina-1 | globuli Rossi | Osmotica di protezione |
| Rene: proximal tubule | Concentration of urine | Eye: ciliary epithelium | Production of aqueous humor | Brain: choriod plexus | Production of cerebrospinal fluid | Lung: alveolar epithelial cells | Alveolar hydration state |
| Aquaporin-2 | Kidney: collecting ducts | Mediates antidiuretic hormone activity |
| Aquaporin-3 * | Kidney: collecting ducts | Reabsorbtion of water into blood |
| Trachea: cellule epiteliali | Secrezione di acqua in trachea | |
| Acquaporina-4 | Rene: condotti di raccolta | Riassorbimento di acqua |
| Cervello: cellule ependimali | CSF equilibrio dei fluidi | |
| Cervello: ipotalamo | Osmosensing funzione? | |
| Lung: epitelio bronchiale | Bronchiale secrezione fluida | |
| Acquaporina-5 | ghiandole Salivari | Produzione di saliva |
| ghiandole Lacrimali | Produzione di lacrime | |
| Acquaporina-6 | Rene | Molto bassa permeabilità all’acqua; funzione? |
| Acquaporina-7 * | le cellule di Grasso | Trasporti glicerolo di adipociti |
| Testicolo e lo sperma | ||
| Acquaporina-8 | Testicolo, pancreas, fegato, gli altri | |
| Acquaporina-9 * | Leucociti | |
| * un aquaglyceroporin | ||
Dovrebbe essere chiaro che acquaporine sono ampiamente distribuiti, e anche che le diverse acquaporine sono diversi funzionalmente importanti specialità.
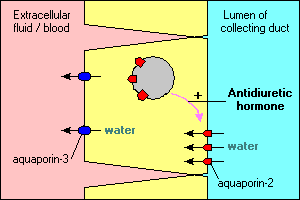
Diverse caratteristiche interessanti e importanti del trasporto dell’acqua mediato da aquaporin sono illustrate nelle principali cellule che allineano i condotti di raccolta nel rene. L’acqua che scorre attraverso questi condotti può continuare e essere svuotata nelle urine o essere riassorbita attraverso l’epitelio e di nuovo nel sangue. Il riassorbimento è essenzialmente nullo a meno che le cellule epiteliali non vedano l’ormone antidiuretico, che stimola fortemente il riassorbimento dell’acqua. Le cellule del condotto di raccolta esprimono almeno due acquaporine:
- Aquaporin-2 è sintetizzato ma, nell’assenza dell’ormone antidiuretico, risiede in un pool di vescicole di membrana all’interno del citoplasma. Il legame dell’ormone antidiuretico al suo recettore nella cellula non solo stimola la trascrizione del gene aquaporin-2, ma fa sì che il pool intracellulare di aquaporin-2 venga inserito nella membrana apicale. La cella è ora in grado di assorbire efficacemente l’acqua dal lume del condotto.
- Aquaporin-3 è costitutivamente espresso nella membrana basolaterale della cellula. Quando l’acqua si inonda nella cellula attraverso i canali aquaporin-2, può rapidamente uscire dalla cellula attraverso i canali aquaporin-3 e fluire nel sangue.
Aquaporine e malattie
Considerando l’importanza del trasporto dell’acqua in una miriade di processi fisiologici, è prevedibile che lesioni nei geni dell’aquaporina o disfunzioni acquisite nelle aquaporine possano causare o contribuire a diversi stati patologici. La ricerca di tali connessioni è ancora presto, ma due chiari esempi di malattia sono stati identificati come derivanti da carenza di acquaporine:
- Le mutazioni nel gene aquaporin-2 causano il diabete insipido ereditario nefrogenico nell’uomo.
- Topi omozigoti per inattivare mutazioni nel gene aquaporin-0 sviluppano cataratta congenita.
- L’obesità ad esordio adulto si sviluppa nei topi omozigoti per l’inattivazione delle mutazioni nel gene aquaporin-7, presumibilmente a causa dell’inefficienza nel trasporto del glicerolo dalle riserve idrolizzate di trigliceridi.
Un piccolo numero di persone è stato identificato con deficit grave o totale in aquaporin-1. È interessante notare che appaiono clinicamente inalterati, ma non sono stati esaminati in condizioni di privazione dell’acqua. Anche i topi con eliminazioni mirate in aquaporin-1 appaiono normali e sani a meno che non siano limitati ai liquidi, nel qual caso diventano gravemente iperosmolari.
Referenze e recensioni
- Borgnia M, Nielsen S, Engel A, Agre P: Biologia cellulare e molecolare dei canali idrici di aquaporin. Annu Rev Biochem 68: 425, 1999.
- deGroot BL, Grubmuller H: Permeazione dell’acqua attraverso le membrane biologiche: Meccanismo e dinamica di aquaporin – 1 e GlpF. Scienza 294:2353, 2001.
- Hibuse T, Proc Nat Acad Sci (USA) 102:10993, 2005.
- Re LS, Agre P: Fisiopatologia dei canali d’acqua aquaporin. Annu Rev Physiol 58: 619, 1998.
- Knepper MA, Inoue T: Regolazione del traffico del canale idrico aquaporin-2 da parte della vasopressina. Cella di opinione Curr Biol 9: 560, 1997.
- Lee MD, King LS, Agre P: La famiglia aquaporin delle proteine del canale dell’acqua nella medicina clinica. Medicina 76:141, 1997.
- Preston GM, Carroll TP, Guggino WP Agre P: Aspetto dei canali dell’acqua negli ovociti di Xenopus che esprimono la proteina del CHIP28 dei globuli rossi. Scienza 256:385, 1992.
- Sasaki S, Ishibashi K, Marumo F: Aquaporin-2 e -3: Rappresentanti di due sottogruppi della famiglia aquaporin colocalizzati nel condotto di raccolta del rene. Annu Rev Physiol 60: 199, 1998.