i Fatti, Riassunto & Definizione
- Un addotto è un prodotto formato da un’aggiunta di reazione
- Addotti possono essere formate da reagenti che hanno più legami, come alcheni e gruppi carbonilici
- Addotti possono essere formate attraverso due tipi di aggiunta di reazione: elettrofila e nucleofila
- Addotti spesso si formano tra Lewis acidi e basi di Lewis
che Cosa è un addotto?
Un addotto è un prodotto formato alla fine di una reazione di addizione. Questa è una reazione in cui due o più molecole reagiscono e si combinano per formare un prodotto più grande. Questo tipo di reazione può avvenire solo tra composti chimici che hanno più legami-composti come alcheni (doppi legami) e alchini (tripli legami). I gruppi carbonile (C=O) e immina (C=N) possono anche subire reazioni di addizione e quindi formare addotti.
Come si formano gli addotti?
Come accennato in precedenza, gli addotti si formano attraverso reazioni di addizione. In questo tipo di reazione, il doppio legame si rompe parzialmente quando una molecola reagente attacca e aggiunge. La reazione seguente mostra una reazione di addizione tra etene e bromo.

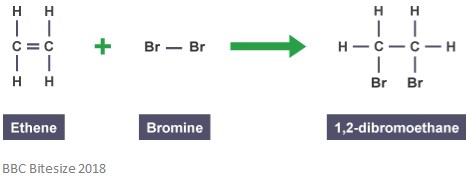
L’addotto in questa reazione è 1,2-dibromoetano. Questo perché è una specie distinta che contiene tutti gli atomi di tutti i componenti.
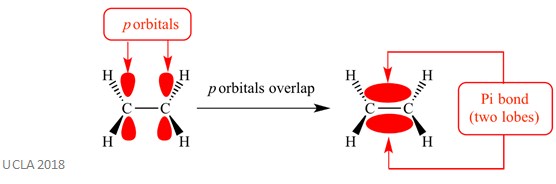
Queste reazioni di addizione di solito coinvolgono legami pi (π). Questo è un tipo complesso di legame in cui gli orbitali p sugli atomi adiacenti si sovrappongono – è questa sovrapposizione che causa il legame pi. Ciò si verifica perpendicolare a qualsiasi legame sigma tra questi due stessi atomi. Questo legame pi ha anche due lobi orbitali: uno è sopra il piano del legame sigma e l’altro è sotto il piano del legame sigma. Il legame pi è mostrato nello schema seguente.

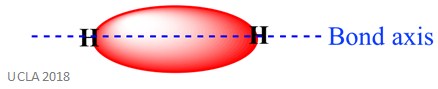
La stessa reazione può coinvolgere anche legami sigma (σ). Questo è un tipo di forma di legame covalente dalla sovrapposizione di orbitali atomici lungo l’asse del legame – in altre parole, lungo la linea che collega i due atomi legati. Ad esempio, il legame sigma in un atomo di idrogeno è formato dalla sovrapposizione di due orbitali 1s – uno da ciascun atomo di idrogeno. Questo è meglio mostrato nell’immagine qui sotto – l’area rossa mostra il legame sigma.

Esistono due tipi principali di reazione di addizione: addizione elettrofila e addizione nucleofila.
Addizione elettrofila
Una reazione di addizione elettrofila è un tipo di reazione in cui si rompe un legame e si formano due nuovi legami. Come discusso in precedenza, il reagente deve avere un legame doppio o triplo-l’elettrofilo si aggiunge a un legame pi in questo caso. Questa è una reazione di addizione, e quindi nulla è perso nel processo – tutti gli atomi trovati nelle molecole reagenti si trovano anche nell’addotto.

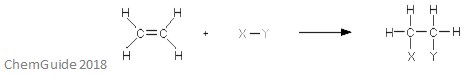
L’immagine sopra mostra la base di una reazione di addizione elettrofila. Come potete vedere, tutti gli atomi nei reagenti si trovano nell’addotto.
Addizione nucleofila
Una reazione di addizione nucleofila è un tipo di reazione in cui si rompe un doppio legame e si formano due singoli legami. Un legame doppio o triplo elettrone-carente (elettrofilo) reagisce con qualcosa che è ricco di elettroni (nucleofilo). Il nucleofilo aggiunge un legame pi in questo caso. Un esempio di una reazione di addizione nucleofila è mostrato di seguito.

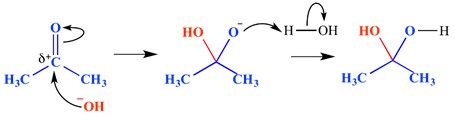
In questo esempio, uno hydroxide idrossido si è aggiunto all’estremità delta positiva del gruppo carbonilico – questo ha formato una molecola intermedia tetraedrica ossianionica. Il risultato finale è, quindi, l’aggiunta di acqua attraverso il legame del gruppo carbonilico pi.
Acidi di Lewis e basi di Lewis
Gli addotti sono spesso noti per formarsi tra acidi di Lewis e basi di Lewis. La molecola formata è chiamata addotto acido-base di Lewis (o complesso acido-base di Lewis). Poiché gli addotti si formano solo attraverso reazioni di addizione (cioè senza la perdita simultanea di un gruppo), le reazioni di Lewis-acido e Lewis-base non possono essere quelle del tipo di sostituzione.
Un buon esempio di questo è la reazione tra THF e BH3, che è mostrata nell’immagine qui sotto. Come vedrai, questi addotti acido-base di Lewis sono mostrati con punti-questi rappresentano elettroni.

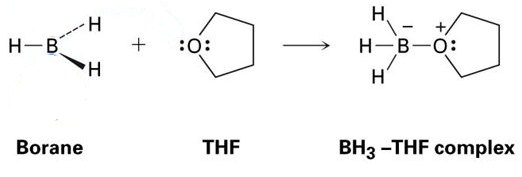
Come puoi vedere, l’unico prodotto formato è il complesso BH3-THF, il che significa che è un addotto.
Questi tipi di reazioni possono anche essere raffigurati con frecce – queste frecce rappresentano la donazione di elettroni dalla base all’acido. La stessa reazione è mostrata sotto, ma con le frecce per indicare la donazione di elettroni.

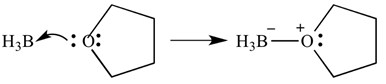
È importante notare che queste frecce hanno due “barbe” all’estremità appuntita. Ciò indica che una coppia di elettroni è stata donata. Se viene donato un solo elettrone, la freccia avrà solo un bardo sull’estremità appuntita.
In questo caso, l’acido di Lewis è borano e la base di Lewis è THF. Come puoi vedere, la base ha donato una coppia solitaria di elettroni all’acido per formare un legame ossigeno-boro.
I composti che non sono in grado di formare addotti a causa della forma delle molecole sono chiamati coppie di Lewis frustrate.
Ulteriori letture
http://www.chem.ucla.edu/~harding/IGOC/L/lewis_acid_base_adduct.html