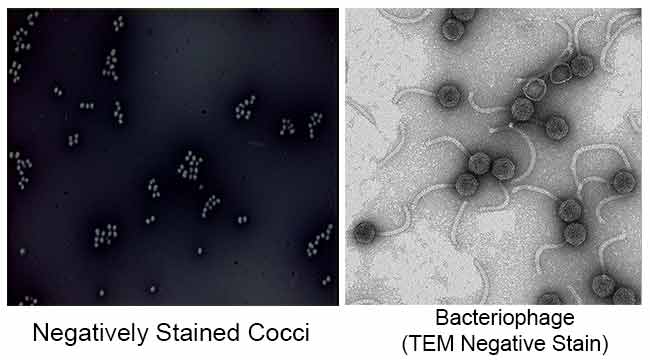
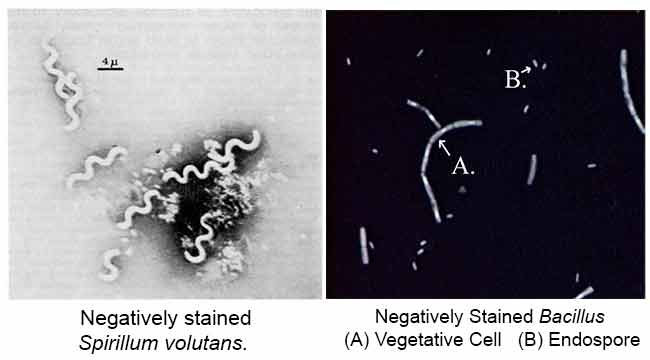
Lo scopo principale della colorazione negativa è studiare la forma morfologica, le dimensioni e la disposizione delle cellule batteriche difficili da macchiare. ad esempio: Spirilla. Può anche essere usato per macchiare le cellule che sono troppo delicate per essere calore-riparate.
È anche usato per preparare campioni biologici per la microscopia elettronica. Viene utilizzato per visualizzare virus, batteri, flagelli batterici, strutture di membrana biologiche e proteine o aggregati proteici, che hanno tutti un basso potere di dispersione degli elettroni. Viene anche utilizzato per lo studio e l’identificazione di aggregati lipidici acquosi come liposomi lamellari (le), micelle sferiche invertite (M) e fasi cilindriche HII esagonali invertite (H) mediante microscopia elettronica a trasmissione di colorazione negativa.
Principio della colorazione negativa
La colorazione negativa richiede un colorante acido come l’inchiostro indiano o la nigrosina.
L’inchiostro indiano o la nigrosina è una macchia acida. Ciò significa che la macchia cede prontamente uno hydrogen idrogeno (protone) e il cromoforo del colorante viene caricato negativamente. Poiché la superficie della maggior parte delle cellule batteriche è caricata negativamente, la superficie cellulare respinge la macchia. Il vetro della diapositiva si macchia, ma le cellule batteriche non lo faranno. I batteri appariranno come macchie chiare su uno sfondo scuro.
Reagenti di Colorazione Negativa
Inchiostro indiano
Nigrosina
Nigrosina 100 gm / L, Formalina 5 ml / L in acqua
Procedura di colorazione Negativa
1. Posizionare una goccia molto piccola (più di un ciclo pieno, meno di una goccia che cade libera dal contagocce) di nigrosin vicino a un’estremità di un vetrino ben pulito e fiammato.
2. Rimuovere una piccola quantità di coltura dall’inclinazione con un ciclo di inoculazione e disperderla nella goccia di macchia senza diffondere la goccia.

3. Utilizzare un altro vetrino pulito per diffondere la goccia di macchia contenente l’organismo utilizzando la seguente tecnica.

4. Appoggiare un’estremità della diapositiva pulita al centro della diapositiva con la macchia. Inclinare la diapositiva pulita verso la goccia formando un angolo acuto e disegnare quella diapositiva verso la goccia fino a quando non tocca la goccia e fa sì che si diffonda lungo il bordo della diapositiva spalmatore. Mantenendo un piccolo angolo acuto tra le diapositive, spingere la diapositiva spalmatore verso l’estremità pulita della diapositiva essendo macchiato trascinando la goccia dietro la diapositiva spalmatore e producendo un ampio, anche, striscio sottile.
 |
 |
5. Lasciare asciugare lo striscio senza riscaldamento.

6. Mettere a fuoco un’area sottile sotto l’immersione in olio e osservare le cellule non colorate circondate dalla macchia grigia.
Procedura per la visualizzazione al microscopio elettronico a trasmissione (TEM)
- Tenere una griglia rivestita flim lato verso l’alto in un paio di pinze autobloccanti.
- Fare una miscela 1:1 di campione e macchia negativa (ad es. 2% uranil acetato o 2% sodio o potassio fosfotungstato, pH 7.4). Aggiungere 5µl alla griglia. Particelle più piccole adsorbono alla superficie della griglia più rapidamente di particelle più grandi.
In alternativa il campione miscelato con fissativo può essere aggiunto alla griglia prima della successiva colorazione negativa. - Incubare per 30-90 secondi quindi rimuovere il liquido in eccesso con il bordo strappato di un
pezzo di carta da filtro. - Asciugare all’aria ed esaminare nel TEM.
Risultati di colorazione negativa