Generic Name: epinastine hydrochloride
Dosage Form: ophthalmic solution
Medically reviewed by Drugs.com. Last updated on June 1, 2020.
- Overview
- Side Effects
- Dosage
- Professional
- Pregnancy
- More
Indications and Usage for Epinastine HCl Ophthalmic Solution
Epinastine HCl Ophthalmic Solution 0.Lo 05% è indicato per la prevenzione del prurito associato alla congiuntivite allergica.
Epinastine HCl Ophthalmic Solution Dosaggio e somministrazione
La dose raccomandata è di una goccia in ciascun occhio due volte al giorno.
Il trattamento deve essere continuato per tutto il periodo di esposizione (cioè fino al termine della stagione dei pollini o fino alla fine dell’esposizione all’allergene incriminato), anche in assenza di sintomi.
Forme di dosaggio e dosaggi
Soluzione contenente 0.5 mg/mL epinastina HCl
Controindicazioni
Nessuno
Avvertenze e Precauzioni
la Contaminazione di Punta e Soluzione
i Pazienti devono essere istruiti ad evitare che la punta dell’erogazione di un contenitore a contatto con l’occhio, le strutture circostanti, le dita, o qualsiasi altro tipo di superficie al fine di evitare la contaminazione della soluzione, comuni batteri noti per causare infezioni oculari. L’uso di soluzioni contaminate può causare gravi danni agli occhi e conseguente perdita della vista.
Il flacone deve essere tenuto ben chiuso quando non in uso.
Uso con lenti a contatto
I pazienti devono essere avvertiti di non indossare lenti a contatto se gli occhi sono rossi. Epinastine HCl Ophthalmic Solution 0.05% non deve essere usato per trattare l’irritazione correlata alle lenti a contatto.
Il conservante contenuto in Epinastina HCl Soluzione oftalmica 0,05%, benzalconio cloruro, può essere assorbito da lenti a contatto morbide. Le lenti a contatto devono essere rimosse prima dell’instillazione di Epinastina HCl Soluzione oftalmica allo 0,05% e possono essere reinserite dopo 10 minuti dalla somministrazione.
Solo per uso oftalmico topico
Epinastina HCl Soluzione oftalmica 0.05% è solo per uso oftalmico topico e non per iniezione o uso orale.
Reazioni avverse
Esperienza negli studi clinici
Poiché gli studi clinici sono condotti in condizioni molto variabili, i tassi di reazione avversa osservati negli studi clinici di un farmaco non possono essere confrontati direttamente con i tassi negli studi clinici di un altro farmaco e potrebbero non riflettere i tassi osservati nella pratica.
Le reazioni avverse oculari più frequentemente riportate che si sono verificate in circa l ‘ 1-10% dei pazienti sono state sensazione di bruciore agli occhi, follicolosi, iperemia e prurito.
Le reazioni avverse non oculari più frequentemente riportate sono state infezioni (sintomi del raffreddore e infezioni delle vie respiratorie superiori), osservate in circa il 10% dei pazienti, e cefalea, rinite, sinusite, aumento della tosse e faringite, osservate in circa l ‘ 1-3% dei pazienti.
Alcune di queste reazioni erano simili alla malattia di base oggetto di studio.
Esperienza post-marketing
Nella pratica clinica sono state identificate le seguenti reazioni durante l ‘ uso post-marketing di Epinastina HCl Soluzione oftalmica 0,05%. Poiché sono segnalati volontariamente da una popolazione di dimensioni sconosciute, non è possibile effettuare stime della frequenza. Le reazioni, che sono state scelte per l’inclusione a causa della loro gravità, frequenza di segnalazione, possibile nesso causale con Epinastina HCl Soluzione oftalmica 0,05%, o una combinazione di questi fattori, includono: aumento della lacrimazione.
USO IN POPOLAZIONI SPECIFICHE
Gravidanza
Effetti teratogeni
Categoria di gravidanza C
In uno studio sullo sviluppo embriofetale in ratti gravidi, è stata osservata tossicità materna senza effetti embriofetali ad una dose orale di circa 150.000 volte la dose massima raccomandata di 0,0014 mg/kg/die su base mg / kg. Riassorbimento totale e aborto sono stati osservati in uno studio embriofetale in conigli gravidi ad una dose orale di circa 55.000 volte la MROHD. In entrambi gli studi, non sono stati osservati effetti teratogeni indotti dal farmaco.
L ‘epinastina ha ridotto l’ aumento di peso corporeo dei cuccioli in seguito ad una dose orale somministrata a ratti gravidi pari a circa 90.000 volte la MROHD.
Non esistono tuttavia studi adeguati e ben controllati su donne in gravidanza. Poiché gli studi sulla riproduzione animale non sono sempre predittivi della risposta umana, Epinastine HCl Ophthalmic Solution 0.05% deve essere usato durante la gravidanza solo se il potenziale beneficio giustifica il potenziale rischio per il feto.
Madri che allattano
Uno studio su ratti che allattavano ha rivelato l’escrezione di epinastina nel latte materno. Non è noto se questo farmaco sia escreto nel latte umano. Poiché molti farmaci sono escreti nel latte umano, si deve usare cautela quando Epinastina HCl soluzione oftalmica 0,05% viene somministrato a una donna che allatta.
Uso pediatrico
La sicurezza e l’efficacia nei pazienti pediatrici di età inferiore ai 2 anni non sono state stabilite.
Uso geriatrico
Non sono state osservate differenze complessive in termini di sicurezza o efficacia tra pazienti anziani e più giovani.
Epinastina HCl Soluzione oftalmica Descrizione
Epinastina HCl Soluzione oftalmica 0.05% is a clear, colorless, sterile isotonic solution containing epinastine HCl, an antihistamine and an inhibitor of histamine release from the mast cell for topical administration to the eyes.
Epinastine HCl is represented by the following structural formula:
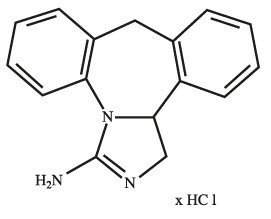
C16H15N3HCl Mol. Wt. 285.78
Chemical Name:
3-Amino-9,13b-dihydro-1H-dibenzimidazoazepine hydrochloride
Each mL contains: Active: Epinastine HCl 0.05% (0.5 mg/mL) equivalent to epinastine 0.044% (0.44 mg/mL); Preservative: Benzalkonium chloride 0.01%; Inactives: Edetato disodio, diidrato; acqua depurata; cloruro di sodio; fosfato di sodio, monobasico, anidro; e idrossido di sodio e / o acido cloridrico (per regolare il pH).
Epinastina HCl Soluzione oftalmica 0,05% ha un pH di circa 7 e un intervallo di osmolalità da 250 a 310 mOsm/kg.
Epinastina HCl Soluzione oftalmica-Farmacologia clinica
Meccanismo d’azione
L’epinastina è un antagonista del recettore H1 diretto e attivo per via topica e un inibitore del rilascio di istamina dal mastocita. L’epinastina è selettiva per il recettore H1 dell’istamina e ha affinità per il recettore H2 dell’istamina. L’epinastina possiede anche affinità per i recettori α1, α2 e 5-HT2.
Farmacocinetica
Quattordici soggetti, con congiuntivite allergica, hanno ricevuto una goccia di Epinastina HCl Soluzione oftalmica allo 0,05% in ciascun occhio due volte al giorno per 7 giorni. Al giorno 7, dopo circa due ore sono state raggiunte concentrazioni plasmatiche medie massime di epinastina pari a 0,04±0,014 ng/ml, indicando una bassa esposizione sistemica. Sebbene queste concentrazioni rappresentino un aumento rispetto a quelle osservate dopo una singola dose, i valori dell ‘Area Sotto la Curva (AUC) del giorno 1 e del giorno 7 sono rimasti invariati, indicando che non vi è alcun aumento dell’ assorbimento sistemico con dosi multiple. L ‘ epinastina si lega per il 64% alle proteine plasmatiche. La clearance sistemica totale è di circa 56 L / ora e l ‘ emivita terminale di eliminazione plasmatica è di circa 12 ore. L’epinastina viene escreta principalmente immodificata. Circa il 55% di una dose endovenosa viene recuperato invariato nelle urine con circa il 30% nelle feci. Meno del 10% viene metabolizzato. L ‘ eliminazione renale avviene principalmente attraverso secrezione tubulare attiva.
Tossicologia non clinica
Carcinogenesi, mutagenesi, compromissione della fertilità
In studi di carcinogenesi dietetica di 18 mesi o 2 anni, condotti rispettivamente su topi o ratti, l ‘ epinastina non è risultata cancerogena a dosi fino a 40 mg / kg .
L’epinastina in lotti di nuova sintesi è risultata negativa per mutagenicità nel test Ames / Salmonella e nel test di aberrazione cromosomica in vitro utilizzando linfociti umani. Risultati positivi sono stati osservati con lotti precoci di epinastina in due studi di aberrazione cromosomica in vitro condotti nel 1980 con linfociti periferici umani e con cellule V79, rispettivamente. L’epinastina è risultata negativa negli studi di clastogenicità in vivo, inclusi il test del micronucleo murino e il test di aberrazione cromosomica nei criceti cinesi. L’epinastina è risultata negativa anche nel test di trasformazione cellulare con cellule embrionali di criceto siriano, nel test di mutazione puntuale delle cellule di mammifero V79/HGPRT e nel test di sintesi del DNA non programmata in vivo/in vitro con epatociti primari di ratto.
L ‘ epinastina non ha avuto effetti sulla fertilità dei ratti maschi. Una diminuzione della fertilità nelle femmine di ratto è stata osservata ad una dose orale fino a circa 90.000 volte la MROHD.
Studi Clinici
Epinastina HCl 0.05% ha dimostrato di essere significativamente superiore a veicolo per il miglioramento del prurito oculare in pazienti con congiuntivite allergica negli studi clinici, l’uso di due diversi modelli: (1) congiuntivale antigene sfida (CAC) in cui i pazienti sono stati dosati e, quindi, ha ricevuto l’antigene instillato nel fornice congiuntivale inferiore; e (2) studi sul campo ambientali in cui i pazienti sono stati dosati e valutati durante la stagione delle allergie nel loro habitat naturale. I risultati hanno dimostrato un rapido inizio di azione per epinastina HCl 0,05% entro 3-5 minuti dopo la sfida dell’antigene congiuntivale. La durata dell’effetto è stata dimostrata di 8 ore, rendendo adatto un regime due volte al giorno. Questo regime posologico si è dimostrato sicuro ed efficace fino a 8 settimane, senza evidenza di tachifilassi.
Modalità di fornitura/Conservazione e manipolazione
Epinastina HCl Soluzione oftalmica 0.05% è fornito sterile in bianco opaco LDPE plastica bottiglie con contagocce consigli e bianco in polipropilene (PP) tappi come segue:
| 5 mL, 10 mL | NDC 51991-836-75 |
conservazione: Conservare a temperatura di 20° – 25°C (68° – 77°F) . Tenere il flacone ben chiuso e fuori dalla portata dei bambini.
Informazioni sulla consulenza del paziente
Sterilità della punta del contagocce
I pazienti devono essere avvertiti di non toccare la punta del contagocce su nessuna superficie, poiché ciò potrebbe contaminare il contenuto (vedere AVVERTENZE E PRECAUZIONI, 5.1).
Uso concomitante di lenti a contatto
I pazienti devono essere avvertiti di non indossare lenti a contatto se gli occhi sono rossi. I pazienti devono essere informati che Epinastine HCl Soluzione oftalmica 0,05% non deve essere usato per trattare l’irritazione correlata alle lenti a contatto. I pazienti devono anche essere avvisati di rimuovere le lenti a contatto prima dell’instillazione di Epinastina HCl Soluzione oftalmica 0,05%.
Il conservante contenuto in Epinastina HCl Soluzione oftalmica 0,05%, benzalconio cloruro, può essere assorbito da lenti a contatto morbide. Le lenti possono essere reinserite dopo 10 minuti dalla somministrazione di Epinastina HCl Soluzione oftalmica 0,05%
Solo per uso oftalmico topico
Solo per somministrazione oftalmica topica.
Solo Rx
Distribuito da:
Breckenridge Pharmaceutical, Inc.
Berlin, CT 06037
Prodotto da:
PrimaPharma, Inc.
San Diego, CA 92121
Rev: 04/2020
2323 04/20
PRINCIPAL DISPLAY PANEL – 5 mL Bottle Carton
NDC 51991-836-75
Epinastine HCl
Ophthalmic
Solution,
0.05%
FOR USE IN THE
EYES ONLY
sterile
Rx Only
5 mL sterile
breckenridge
A Towa
Company

| EPINASTINE HYDROCHLORIDE epinastine hydrochloride solution/ drops |
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
Labeler – Breckenridge Pharmaceutical, Inc. (150554335)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| PrimaPharma, Inc. | 079699106 | MANUFACTURE(51991-836) | |
Maggiori informazioni su epinastine ophthalmic
- Effetti collaterali
- Durante la gravidanza o l’allattamento
- Informazioni sul dosaggio
- Prezzi& Coupon
- In inglese
- 3 recensioni
- Classe di farmaci: oftalmico antistaminici e decongestionanti
risorse per i Consumatori
- Informazioni Paziente
- Epinastina Oftalmica (Avanzate di Lettura)
risorse Professionali
- la Prescrizione di Informazione;
- Epinastina (Professional Paziente di Consulenza)
Altre marche Elestat
relativo trattamento guide
- Congiuntivite, Allergica
Disclaimer Medico