Sir,
I carcinomi a cellule squamose (SCC) della pelle sono frequenti tumori maligni della pelle, con un’incidenza del 30 per 100.000 abitanti all’anno nell’Europa occidentale. Nei climi più soleggiati sono ancora più frequenti. SCC di solito si sviluppa da cheratosi attiniche. Oltre alla luce solare, altri fattori predisponenti includono radiazioni ionizzanti, infiammazione cronica con cicatrici, infezioni virali e immunosoppressione. I pazienti sottoposti a trapianto di organi hanno un rischio marcatamente aumentato, forse 200 volte, di sviluppare SCC, a causa della loro terapia immunosoppressiva (1). Lo stesso vale per i pazienti con immunodeficienza dovuta ad altri fattori, ad esempio quelli con infezione da HIV (1, 2).
CASE REPORT
Un uomo di 50 anni presentava un grosso tumore alla guancia sinistra, che si era sviluppato negli ultimi 3 mesi. Il tumore aveva un bordo rialzato e un’ulcera perforata centrale. Aveva viaggiato in Tunisia 6 mesi prima con molta esposizione al sole. Anche se aveva Fitzpatrick tipo di pelle II, non aveva mai praticato la protezione solare. L’esame clinico non ha rivelato ulteriori segni di danno attinico; in particolare non aveva cheratosi attiniche. Dal suo soggiorno in Tunisia, il paziente ha avuto anche una tosse secca cronica. I suoi linfonodi cervicali erano normali alla palpazione e con l’indagine ecografica. La tomografia a risonanza magnetica non ha mostrato infiltrazioni di strutture dei tessuti molli adiacenti. A causa della rapida crescita del tumore e del suo aspetto macroscopico, abbiamo sospettato un cheratoacantoma. L’esame istologico ha rivelato un SCC ben differenziato ma ulcerato. L’analisi citometrica a flusso delle cellule T periferiche ha rivelato uno squilibrio, con solo 5 cellule CD4+/CD3+e 226 cellule CD8 + / CD3 + (rapporto 0,02), indicando immunodeficienza e forse spiegando la rapida crescita del tumore. Nonostante l’ampia consulenza su una malattia immunosoppressiva potenzialmente sottostante, il paziente ha rifiutato ulteriori procedure diagnostiche per l’HIV, nonché ulteriori studi per chiarire la tosse (sospetta polmonite da Pneumocystis jiroveci) ed escludere metastasi. Ha anche rifiutato la ri-escissione con margini più ampi e ha lasciato l’ospedale contro il parere medico.

Fig. 1. La guancia sinistra di un uomo di 50 anni con un grosso tumore. (a) Aspetto dorsale e (b) laterale.
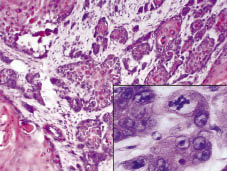
Fig. 2. L’indagine istologica ha rivelato un tumore infiltrante profondo, distruggendo le strutture anatomiche lesionali. Inserto: Il tumore è composto da cheratinociti polimorfi con diverse mitosi (H & E ×200, con ingrandimento digitale).
DISCUSSIONE
Il Cheratoacantoma (KA) fu descritto per la prima volta nel 1889 da Jonathan Hutchinson come ulcera cratiforme del viso. Il più delle volte si presenta come un tumore cutaneo in rapida crescita nelle aree esposte al sole (3). Gli uomini sono colpiti circa 3 volte più spesso delle donne. La distribuzione per età aggiustata mostra che è più frequente nella mezza età e non aumenta l’incidenza negli anziani (a differenza del carcinoma a cellule basali e del SCC) (4). Mentre SCC sviluppare da epitelio di superficie, KAS sono derivati dalla parete del follicolo pilifero appena sopra dove il dotto sebaceo entra. Sono un’entità distinta con caratteristiche cliniche e istologiche specifiche (5). La tendenza alla regressione spontanea e l’ampio grado di cheratinizzazione sono le caratteristiche più sorprendenti, insieme alla tipica architettura simmetrica del tumore (6).
La nosologia esatta e la classificazione del KA sono una questione di dibattito. Alcuni autori considerano il KA come un tumore cutaneo benigno che è il prototipo dei tumori “pseudomalignani” della pelle, mentre altri sostengono che sia una neoplasia maligna – una variante peculiare del SCC – e quindi dovrebbe essere trattato come SCC (7-9). Le difficoltà diagnostiche sono particolarmente vere per le varianti distruttive e persistenti del KA, come il KA gigante o il KA mutilante. Clinicamente, KA si differenzia da SCC per la sua storia di rapida crescita e la sua forma simile a un vulcano. Tuttavia, nel caso qui descritto un grande SCC ha mostrato anche una crescita molto rapida, probabilmente a causa dell’infezione da HIV. Talvolta le lesioni considerate come KAS devono essere riclassificate come SCC sulla base del loro decorso clinico successivo. Oltre a una diagnosi errata, altre spiegazioni sono la combinazione di KA e SCC e la trasformazione di KA in SCC. Inoltre, alcuni KAS possono essere varianti ben differenziate di SCC, come proposto da Ackerman (10-12).
A causa delle difficoltà nel distinguere tra KA e SCC, il trattamento di scelta per tutti i tipi di KAs è ancora l’escissione chirurgica con verifica istopatologica della diagnosi (8-10). Se la chirurgia è impossibile, si possono prendere in considerazione le radiazioni ionizzanti. Diverse altre opzioni terapeutiche, come il 5-fluorouracile topico, iniezioni intra-lesionali di interferone-alfa, metotrexato o bleomicina e retinoidi somministrati per via sistemica, sono state riportate per essere efficaci in singoli casi, ma non ci sono studi clinici controllati che dimostrino l’efficienza di questi trattamenti (1, 4, 5).
Alcuni SCC possono crescere rapidamente, imitando un KA, come nel caso descritto qui. La ragione della rapida crescita di KAs non è chiara; sono state offerte diverse ipotesi, tra cui l’immunosoppressione e l’esposizione a un’eccessiva luce solare. I KAS, specialmente quelli che non possono essere chiaramente distinti da SCC, devono essere trattati con un’ampia escissione chirurgica, in quanto possono avere una prognosi sfavorevole con sviluppo precoce di metastasi.
1. Sterry W, Stockfleth E. Tumore epiteliale maligno. In: Braun-Falco O, Plewig G, Wolff HH, Burgdorf WH, Landthaler M, editori. Dermatologie e Venerologie. 5 ° edn. Heidelberg: Springer, 2005: p. 1267-1276.
2. Nguyen P, Vin-Christian K, Ming ME, Berger T. Carcinomi a cellule squamose aggressive in persone infette dal virus dell’immunodeficienza umana. Arch Dermatol 2002; 138: 758–763.
3. Rinker MH, Fenske NA, Scalf LA, Vetro LF. Varianti istologiche del carcinoma a cellule squamose della pelle. Controllo del cancro 2001; 8: 354-363.
4. Mac Kie RM, Quinn AG. Cancro della pelle non melanoma e tumori della pelle epidermica. In: Burns T, Breathnack S, Cox N, Griffiths C, editori. Il manuale di dermatologia di Rook. 7 ° edn. Massachusetts: Blackwell Science, 2004: p. 43-46.
5. Kurschat P, Hess S, Hunzelmann N, Scharffetter-Kochanek K. Keratoacanthoma centrifugum marginatum accompagnato da un’ampia reazione di corpo estraneo granulomatoso. Dermatol Online J 2005; 11: 16.
6. Bayer-Garner IB, Ivan D, Schwartz MR, Tschen JA. L’immunopatologia della regressione nella cheratosi lichenoide benigna, nel cheratoacantoma e nel nevo aureo. Clin Med Res 2004; 2: 89-97.
7. Cribier B, Asch P, Grosshans E. Differenziare il carcinoma a cellule squamose dal cheratoacantoma utilizzando criteri istopatologici. È possibile? Uno studio di 296 casi. Dermatologia 1999; 199: 208-212.
8. Beham A, Regauer S, Soyer HP, Beham-Schmid C. Keratoacanthoma: una variante clinicamente distinta del carcinoma a cellule squamose ben differenziato. Adv Anat Pathol 199; 5: 269-280.
9. Warner DM, Fiori F, Ramos-Caro FA. Cheratoacantoma solitario (carcinoma a cellule squamose): gestione chirurgica. Int J Dermatol 1995; 34: 17-19.
10. E ‘ il primo album della band. Il cheratoacantoma solitario è un carcinoma a cellule squamose: tre esempi con metastasi. Am J Dermatopathol 1993; 15: 332-342.
11. Sanchez YE, Simon P, Requena L, Ambrojo P, de Eusebio E. Cheratoacantoma solitario: una proliferazione di auto-guarigione che spesso diventa maligna. Am J Dermatopathol 2000; 22: 305-310.
12. Lawrence N, Reed RJ. Cheratoacantoma attinico. Speculazioni sulla natura della lesione e sul ruolo dell’immunità cellulare nella sua evoluzione. Am J Dermatopathol 1990; 12: 517-533.