Identificare H più acido di una molecola
Un approccio metodico funziona meglio. In poche parole, è necessario eseguire la scansione della molecola per gruppi funzionali acidi e quindi classificare la reattività di questi gruppi. Il gruppo funzionale più acido di solito tiene l’H più acido nell’intera molecola.
“Scan and rank” sembra semplice, ma nasconde diverse difficoltà che vengono elaborate di seguito.
Scansione di una molecola per gruppi funzionali acidi noti
I protoni acidi sono solitamente legati a O o N. Pertanto, il primo passo è cercare tutte le obbligazioni OH e NH.
Tuttavia, quando si individuano i legami OH e NH, sarà necessario decidere se questi atomi legati debbano essere raggruppati in un gruppo funzionale con atomi vicini.
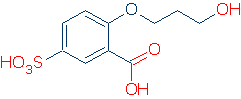
L’UNICO metodo conveniente per identificare un gruppo funzionale è conoscerne già alcuni. Ad esempio, se sai che ROH, RCO2H e RSO3H sono gruppi funzionali acidi comuni, non avrai problemi a trovare gruppi acidi nella seguente molecola (i gruppi corretti sono contrassegnati in rosso).
Classifica separatamente l’acidità OH e NH
I valori pKa degli acidi OH e NH comuni si estendono su ampi intervalli e i loro intervalli si sovrappongono. Classifica procede più rapidamente se si classifica gli acidi OH e NH separatamente, e quindi confrontare i migliori candidati in ogni categoria.
Il metodo più conveniente per classificare i gruppi acidi è quello di conoscere già i loro valori caratteristici di pKa. Se conosci questi valori per tutti i gruppi acidi nella tua molecola, allora il gruppo con il pKa più basso contiene il caso H. più acido chiuso.
Se non ricordi i valori pKa per tutti i gruppi acidi, alcuni principi generali possono guidarti.
#1 Importanza – gli acidi caricati positivamente sono più forti degli acidi neutri. Gli acidi caricati negativamente sono raramente acidi. Se si confrontano i valori pKa degli acidi OH comuni, si vedrà che gli acidi ROH2+ (che include H3O+ e R2OH+) sono considerevolmente più forti degli acidi neutri, come RCO2H, PhOH e ROH. Gli unici acidi neutri che sono più forti di ROH2 + sono H2SO4 e alcuni altri RSO3H.
La regola di carica formale si applica ancora più fortemente agli acidi NH. La differenza di pKa tra H3O + e H2O è di 18 unità, mentre la differenza di pKa tra NH4+ e NH3 è di 26 unità gigantesche.
#2 Importanza – cerca gruppi attivanti, inclusi RSO2, RC=O e Ph. La seguente tabella mostra come ogni gruppo di atomi attiva un acido OH (i valori pKa vanno da 16 a -2):
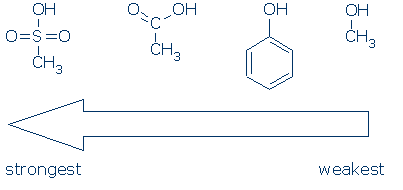
CH3 è considerato un gruppo spettatore ovunque appaia in queste molecole. È non polare e non esercita un significativo effetto induttivo sul campo ed è incapace di delocalizzare la carica. Di conseguenza, è possibile sostituire CH3 con altri gruppi di spettatori (ad esempio, H e altri R) senza influenzare molto la reattività.
Due punti aggiuntivi dovrebbero essere fatti per quanto riguarda l’attivazione dei gruppi.
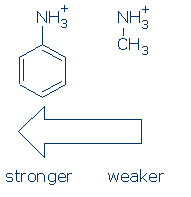
Innanzitutto, i gruppi esercitano un effetto simile sugli acidi NH (e la sequenza di attivazione è la stessa: RSO2> RC=O> Ph). Come succede, hai solo bisogno di imparare l’effetto del Ph su NH+ per questo corso:
In secondo luogo, i gruppi di attivazione devono essere collegati direttamente al gruppo OH (o NH) per attivarlo. I seguenti composti hanno valori pKa simili perché i gruppi attivanti non sono legati direttamente a OH: CH3C (=O)CH2OH, PhCH2OH e CH3CH2OH.
#3 Importanza – a parità di condizioni, un acido OH è più acido di un acido NH. Questo principio può essere molto utile se usato correttamente. La mia preoccupazione è che tu capisca cosa si intende per ” tutte le cose sono uguali.”Ciò significa che O e N devono avere la stessa carica formale (articolo #1) e devono essere legati allo stesso gruppo di attivazione (articolo #2). Tuttavia, le differenze nei gruppi di spettatori non contano.
Alcuni confronti validi includono:
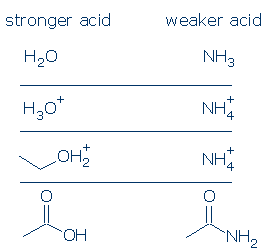
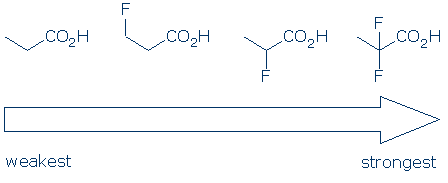
#4 Importanza – all’interno di una categoria di gruppi funzionali, utilizzare gli effetti sostituenti per confrontare gli acidi. I sostituenti elettronegativi di solito aumentano l’acidità di un gruppo funzionale attraverso una combinazione di effetti di campo e induttivi. Questi effetti sono migliorati quando 1) il sostituente si trova più vicino al gruppo acido e 2) ci sono più sostituenti. Dati questi principi, ci aspettiamo che l’acidità di questi acidi carbossilici segua questa tendenza: