dipolen
om de aard van niet-covalente interacties te begrijpen, moeten we eerst terugkeren naar covalente bindingen en ons verdiepen in het onderwerp van dipolen. Veel van de covalente bindingen die we hebben gezien – tussen twee koolstofatomen, bijvoorbeeld, of tussen een koolstof en een waterstof-hebben betrekking op het ongeveer gelijke delen van elektronen tussen de twee atomen in de binding. In deze voorbeelden hebben de twee atomen ongeveer dezelfde elektronegativiteit. Herinner je uit je algemene scheikunde cursus dat elektronegativiteit verwijst naar” de kracht van een atoom in een molecuul om elektronen naar zichzelf aan te trekken ” (Dit is de definitie die Linus Pauling, de eminente 20e-eeuwse Amerikaanse chemicus die primair verantwoordelijk was voor het ontwikkelen van veel van de bindingsconcepten die we geleerd hebben).
in de organische chemie hebben we echter vaak te maken met covalente bindingen tussen twee atomen met verschillende elektronegativiteit, en in deze gevallen is het delen van elektronen niet gelijk: de meer elektronegatieve kern trekt de twee elektronen dichter. In de koolstof-zuurstofbinding van een alcohol, bijvoorbeeld, worden de twee elektronen in de sigmabinding dichter aan de zuurstof dan aan de koolstof gehouden, omdat zuurstof beduidend elektronegatiever is dan koolstof. Hetzelfde geldt voor de zuurstof-waterstofbinding, omdat waterstof iets minder elektronegatief is dan koolstof en veel minder elektronegatief dan zuurstof.
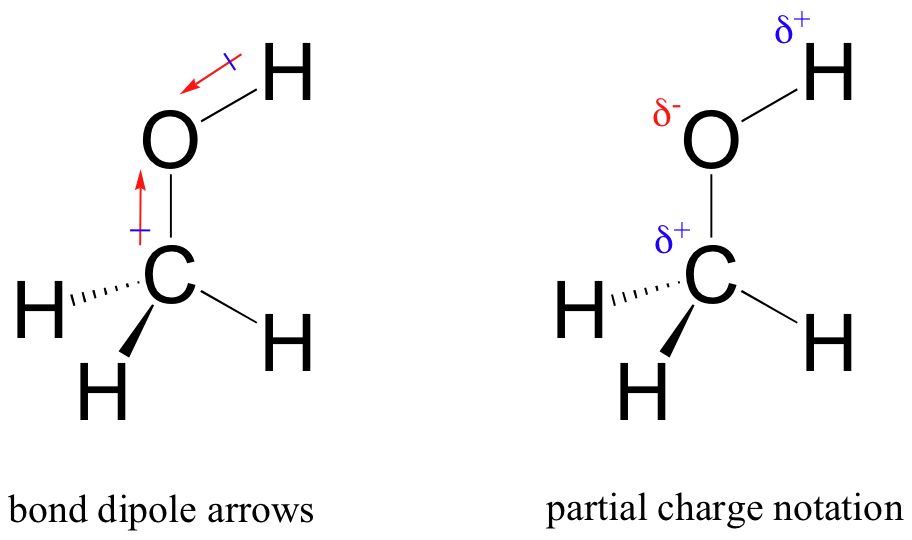
het resultaat van deze ongelijke verdeling is wat we een obligatiedipool noemen, die bestaat in een polaire covalente binding. Een bindingsdipool heeft zowel negatieve als positieve uiteinden, of Polen, waar de elektronendichtheid lager is (de positieve pool) en hoger (de negatieve pool). Het verschil in elektronendichtheid kan worden uitgedrukt met behulp van de Griekse letter delta om ‘partiële positieve’ en ‘partiële negatieve’ lading op de atomen aan te duiden. ‘Dipoolpijlen’, met een positief teken op de staart, worden ook gebruikt om de negatieve (hogere elektronendichtheid) richting van de dipool aan te geven.
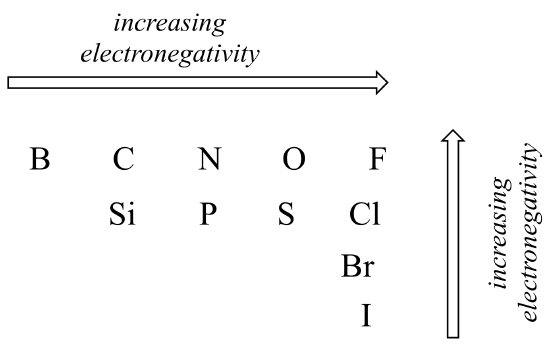
de mate van polariteit in een covalente binding hangt af van het verschil in elektronegativiteit tussen de twee atomen. Elektronegativiteit is een periodieke trend: het neemt toe van links naar rechts over een rij van het periodiek systeem van de elementen, en neemt ook toe naarmate we een kolom omhoog bewegen. Daarom is zuurstof meer elektronegatief dan stikstof, wat op zijn beurt meer elektronegatief is dan koolstof. Zuurstof is ook meer elektronegatief dan zwavel. Fluor, in de rechterbovenhoek van het periodiek systeem, is de meest elektronegatieve van de elementen. Waterstof is iets minder elektronegatief dan koolstof.
periodieke trends in elektronegativiteit
oefening 2.26
gebruik wat u over atomaire orbitalen gebruikt, rationaliseer de periodieke trends in elektronegativiteit. Waarom neemt het toe van links naar rechts en daalt het van boven naar beneden? Dit is een goede vraag om door te praten met klasgenoten en een instructeur of tutor.
oplossingen voor oefeningen
De meeste moleculen bevatten zowel polaire als niet-polaire covalente bindingen. Afhankelijk van de locatie van polaire bindingen en bindingsgeometrie, kunnen moleculen een netto polariteit bezitten, een moleculair dipoolmoment genoemd. Water, zoals je je waarschijnlijk herinnert, heeft een dipoolmoment dat het resultaat is van de gecombineerde dipolen van zijn twee zuurstof-waterstofbindingen. Fluoromethaan heeft ook een dipoolmoment.
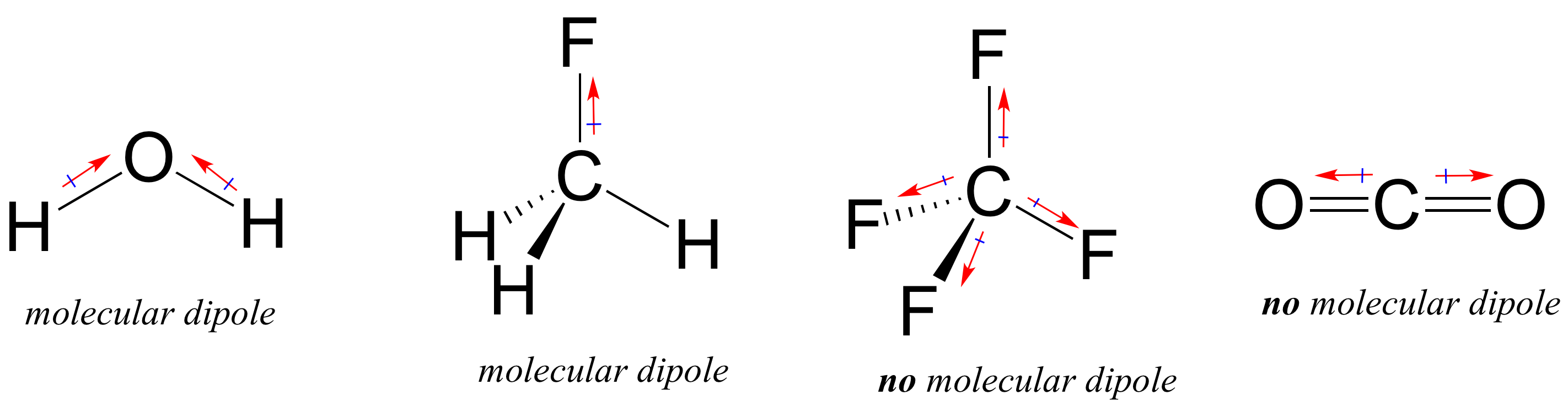
Tetrafluormethaan heeft echter vier polaire bindingen die gelijkmatig naar de vier hoeken van een tetaëder trekken, wat betekent dat er, hoewel er vier bindingsdipolen zijn, geen globaal moleculair dipoolmoment is. Koolstofdioxide mist ook een moleculair dipoolmoment.
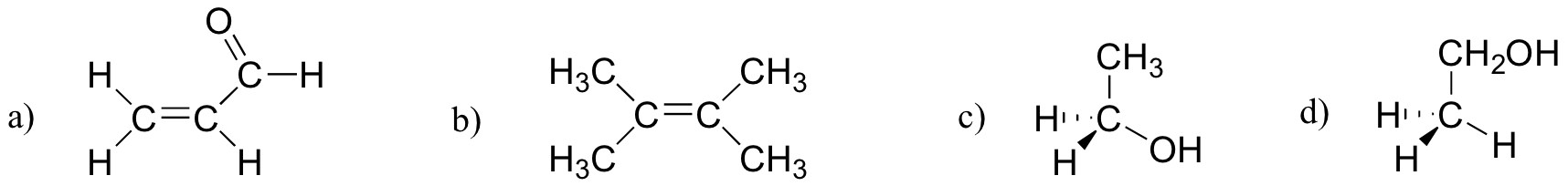
oefening 2.27
welke van de onderstaande moleculen hebben moleculaire dipoolmomenten?
oplossingen voor oefeningen