Feiten, Samenvatting & Definitie
- Een adduct is een product wordt gevormd door een additiereactie
- Adducts kan alleen worden gevormd van reactanten die hebben meerdere obligaties, zoals alkenen en carbonyl groepen
- Adducts kan worden gevormd door twee soorten additiereactie: elektrofiel en nucleophilic
- Adducts vormen vaak tussen Lewis Lewis zuren en basen
Wat is een adduct?
een adduct is een product dat wordt gevormd aan het einde van een additie. Dit is een reactie waarbij twee of meer moleculen reageren en combineren om één groter product te vormen. Dit type reactie kan alleen voorkomen tussen chemische verbindingen die meerdere bindingen hebben-verbindingen zoals alkenen (dubbele bindingen) en alkynen (drievoudige bindingen). Carbonyl (C=O) en imine (C=N) groepen kunnen ook adducten ondergaan en zo adducten vormen.
Hoe worden adducten gevormd?
zoals eerder vermeld, worden adducten gevormd door adductreacties. In dit type van reactie, breekt de dubbele band gedeeltelijk wanneer een reagerende molecuul aanvalt en toevoegt. De reactie hieronder toont een additie tussen etheen en broom.

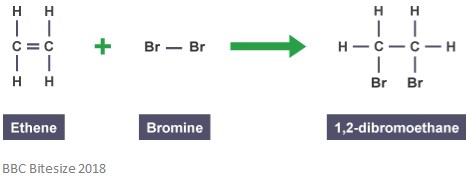
het adduct in deze reactie is 1,2-dibroomethaan. Dit komt omdat het een afzonderlijke soort is die alle atomen van alle componenten bevat.
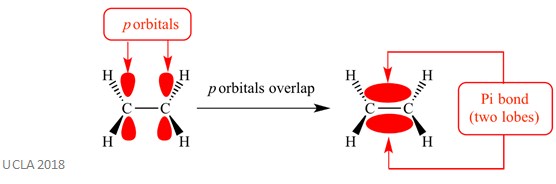
deze additiereacties hebben meestal betrekking op PI (π) – bindingen. Dit is een complex type binding waarin de p-orbitalen op aangrenzende atomen elkaar overlappen – het is deze overlapping die de pi-binding veroorzaakt. Dit komt loodrecht op om het even welke sigmabindingen tussen die twee zelfde atomen voor. Deze pi-binding heeft ook twee orbitale kwabben-een bevindt zich boven het vlak van de sigma-binding, en de andere bevindt zich onder het vlak van de sigma-binding. De pi-binding wordt in het onderstaande diagram weergegeven.

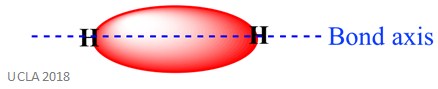
dezelfde reactie kan ook sigma (σ) – bindingen omvatten. Dit is een soort covalente binding vorm door de overlapping van atomaire orbitalen langs de binding as – met andere woorden, langs de lijn die de twee gebonden atomen verbindt. Bijvoorbeeld, de sigma binding in een waterstofatoom wordt gevormd door de overlapping van twee 1s orbitalen-een van elk waterstofatoom. Dit wordt beter weergegeven in de afbeelding hieronder – het rode gebied toont de sigma bond.

Er zijn twee belangrijke soorten additie: elektrofiele additie en nucleofiele additie.
elektrofiele additie
een elektrofiele additie is een reactie waarbij een binding wordt verbroken en twee nieuwe bindingen worden gevormd. Zoals eerder besproken, moet de reactant een dubbele of drievoudige band hebben-de elektrofiel voegt in dit geval aan een pi-band toe. Dit is een optiereactie, en dus gaat er niets verloren in het proces – alle atomen die in de reactantmoleculen worden gevonden, worden ook in het adduct gevonden.

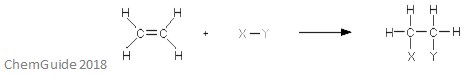
bovenstaande afbeelding toont de basis van een elektrofiele additie. Zoals je kunt zien, zijn alle atomen in de reactanten gevonden in het adduct.
nucleofiele additie
een nucleofiele additie is een reactie waarbij een dubbele binding wordt verbroken en twee enkelvoudige bindingen worden gevormd. Een elektron-deficiënte (elektrofiele) dubbele of drievoudige binding reageert met iets dat elektronenrijk is (nucleofiel). Het nucleofiel draagt in dit geval bij aan een pi-binding. Een voorbeeld van een nucleofiele additie wordt hieronder getoond.

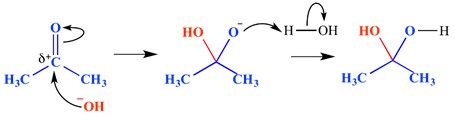
In dit voorbeeld is een hydroxide – ion toegevoegd aan het delta-positieve einde van de carbonylgroep-dit heeft een oxyanionisch tetrahedraal tussenmolecuul gevormd. Het eindresultaat is dus de toevoeging van water over de carbonylgroep-pi-binding.
Lewis-zuren en Lewis-basen
adducten kunnen zich vaak tussen Lewis-zuren en Lewis-basen vormen. Het gevormde molecuul wordt een Lewis zuur-base adduct (of een Lewis zuur-base complex) genoemd. Aangezien adducten alleen gevormd worden door adducten (dat wil zeggen zonder gelijktijdig verlies van een groep), kunnen Lewis-zuur-en Lewis-base-reacties niet het substitutietype zijn.
een goed voorbeeld hiervan is de reactie tussen THF en BH3, die in onderstaande afbeelding wordt getoond. Zoals je zult zien, worden deze Lewis zuur-Lewis base adducten getoond met stippen – deze vertegenwoordigen elektronen.

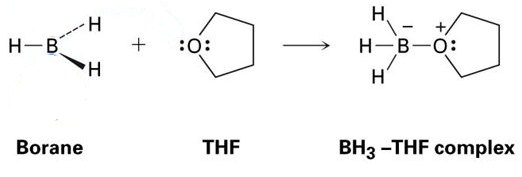
zoals u kunt zien, is het enige product dat gevormd wordt het BH3-THF complex, wat betekent dat het een adduct is.
Dit soort reacties kan ook worden afgebeeld met pijlen-deze pijlen vertegenwoordigen de donatie van elektronen van de base aan het zuur. Dezelfde reactie wordt hieronder getoond, maar met pijlen om elektronendonatie aan te geven.

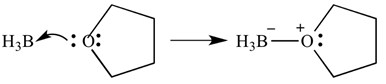
Het is belangrijk op te merken dat deze pijlen twee ‘weerhaken’ hebben op het puntige uiteinde. Dit geeft aan dat een paar elektronen is gedoneerd. Als er maar één elektron wordt gedoneerd, zal de pijl slechts ‘één’ bard hebben op het puntige uiteinde.
in dit geval is het Lewis-zuur boraan en de Lewis-base THF. Zoals je kunt zien, heeft de base een enkel paar elektronen aan het zuur gedoneerd om een zuurstof-boriumbinding te vormen.
verbindingen die vanwege de vorm van de moleculen geen adducten kunnen vormen, worden gefrustreerde Lewis-paren genoemd.
verder lezen
http://www.chem.ucla.edu/~harding/IGOC/L/lewis_acid_base_adduct.html