VIVO Pathofysiologie
andere onderwerpen
Aquaporinen: waterkanalen
Water kruist celmembranen via twee routes: door diffusie via de lipide bilayer en via waterkanalen die aquaporinen worden genoemd. Functionele karakterisering van de eerste aquaporine werd gemeld in 1992, maar er werd vermoed dat waterkanalen ruim voor die tijd bestonden, omdat de osmotische permeabiliteit van sommige soorten epitheliale cellen veel te groot was om te worden verklaard door eenvoudige diffusie door het plasmamembraan.
Eén enkel menselijk aquaporine-1 kanaal vergemakkelijkt het transport van water met een snelheid van ongeveer 3 miljard watermoleculen per seconde. Dit transport lijkt bidirectioneel te zijn, in overeenstemming met de heersende osmotische gradiënt.
De klassieke aquaporinen transporteren oplosmiddelvrij water door celmembranen; ze lijken exclusieve waterkanalen te zijn en doordringen membranen niet tot ionen of andere kleine moleculen. Sommige aquaporinen – bekend als aquaglyceroporinen-transport water plus glycerol en een paar andere kleine moleculen.
de Aquaporinefamilie
tot op heden zijn meer dan 10 verschillende zoogdieraquaporinen geïdentificeerd, en er wordt vermoed dat er nog meer leden aanwezig zijn. Nauw verwante waterkanaaleiwitten zijn geïsoleerd uit planten, insecten en bacteriën. Aquaporine – 1 van menselijke rode bloedcellen was de eerste die werd ontdekt en is waarschijnlijk de best bestudeerde.
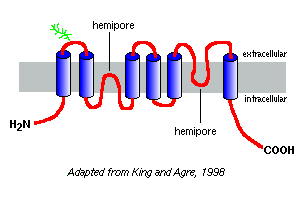
hydrofobiciteitsdiagrammen van hun aminozuursequenties voorspellen dat de aquaporinen zes membraanoverspannende segmenten hebben, zoals weergegeven in het model van aquaporine-1 rechts.
uit studies met aquaporine-1 blijkt dat aquaporinen als homotetramers in het plasmamembraan voorkomen. Elk aquaporin monomeer bevat twee hemiporen, die samenvouwen om een waterkanaal te vormen.
verschillende aquaporinen hebben verschillende patronen van glycosylering. In het geval van aquaporin-1 is de peptide backbone ruwweg 28 kDa en de geglycosyleerde vormen variëren van 40 tot 60 kDa in massa. De meeste aquaporins hebben een eiwitkinase een phosphorylation motief in één van de cytoplasmic lussen, en de differentiële phosphorylation wordt verdacht empart een regelgevende functie aan de molecule.
patronen van Aquaporine-expressie
elk van de aquaporinen heeft een in wezen uniek expressiepatroon tussen weefsels en tijdens de ontwikkeling. Een samenvatting van deze attributen en enkele belangrijke potentiële of bekende functies wordt weergegeven in de volgende tabel:
| belangrijke Expressieplaatsen | Aquaporine-0 | Eye: lens fiber cells | vloeistofbalans binnen de lens |
|---|---|---|
| aquaporine-1 | rode bloedcellen | osmotische bescherming |
| nier: proximal tubule | Concentration of urine | Eye: ciliary epithelium | Production of aqueous humor | Brain: choriod plexus | Production of cerebrospinal fluid | Lung: alveolar epithelial cells | Alveolar hydration state |
| Aquaporin-2 | Kidney: collecting ducts | Mediates antidiuretic hormone activity |
| Aquaporin-3 * | Kidney: collecting ducts | Reabsorbtion of water into blood |
| Trachea: epitheelcellen | uitscheiding van water in de trachea | |
nier: verzamelkanalen | Herabsorptie van water | hersenen: ependymale cellen | CSF vochtbalans | hersenen: hypothalamus | osmosensing functie? |
| Long: bronchiaal epitheel | bronchiale vochtsecretie | |
| Aquaporine-5 | speekselklieren | productie van speeksel | traanklieren | productie van tranen | Aquaporine-6 | nier | zeer lage waterdoorlaatbaarheid; functie? |
| Aquaporine-7 * | Vet cellen | Transporten glycerol uit de adipocyten |
| Testis en sperma | ||
| Aquaporine-8 | Testis, alvleesklier, lever, anderen | |
| Aquaporine-9 * | Leukocyten | |
| * een aquaglyceroporin | ||
Het mag duidelijk zijn dat aquaporins zijn zeer wijd verspreid, en ook dat de verschillende aquaporins hebben verschillende functioneel belangrijke specialiteiten.
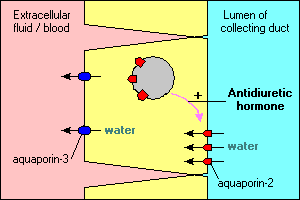
verschillende interessante en belangrijke kenmerken van aquaporine-gemedieerd watertransport worden geïllustreerd in de belangrijkste cellen die de opvangkanalen in de nier leiden. Water stroomt door deze kanalen kan ofwel blijven en worden vernietigd in de urine of worden opnieuw geabsorbeerd door het epitheel en terug in het bloed. De reabsorptie is hoofdzakelijk nihil tenzij de epitheliaale cellen antidiuretisch hormoon zien, dat reabsorptie van water sterk bevordert. Het verzamelen van kanaalcellen drukt ten minste twee aquaporinen uit:
- Aquaporine-2 wordt gesynthetiseerd, maar komt in afwezigheid van antidiuretisch hormoon voor in een pool van membraanblaasjes in het cytoplasma. De Binding van antidiuretisch hormoon aan zijn receptor in de cel stimuleert niet alleen de transcriptie van het aquaporine-2-gen, maar zorgt ervoor dat de intracellulaire pool van aquaporine-2 in het apicale membraan wordt ingebracht. De cel kan nu efficiënt water opnemen uit het lumen van het kanaal.
- Aquaporine-3 wordt constitutief uitgedrukt in het basolaterale membraan van de cel. Wanneer water de cel binnenstroomt via aquaporin-2 kanalen, Kan het snel de cel verlaten via de aquaporin-3 kanalen en in het bloed stromen.
Aquaporinen en ziekte
gezien het belang van watertransport in een groot aantal fysiologische processen, is het te verwachten dat laesies in aquaporingenen of verworven disfunctie in aquaporinen verschillende ziektetoestanden kunnen veroorzaken of daaraan kunnen bijdragen. De zoektocht naar dergelijke verbindingen is nog vroeg, maar twee duidelijke voorbeelden van ziekte zijn geïdentificeerd als gevolg van een tekort aan aquaporinen:
- mutaties in het aquaporine-2 gen veroorzaken erfelijke nefrogene diabetes insipidus bij mensen.
- muizen die homozygoot zijn voor het inactiveren van mutaties in het aquaporine-0 gen ontwikkelen congenitale cataracten.
- obesitas bij volwassenen ontwikkelt zich bij muizen homozygote voor het inactiveren van mutaties in het aquaporine-7 gen, vermoedelijk als gevolg van inefficiëntie bij het transport van glycerol uit gehydrolyseerde triglycerideopslagplaatsen.
een klein aantal mensen is geïdentificeerd met een ernstig of totaal tekort aan aquaporine-1. Interessant, ze lijken klinisch onaangetast, maar zijn niet onderzocht onder omstandigheden van watergebrek. Muizen met gerichte deleties in aquaporin-1 lijken ook normaal en gezond, tenzij ze vochtbeperkt zijn, in welk geval ze ernstig hyperosmolair worden.
referenties en Reviews
- Borgnia M, Nielsen S, Engel a, Agre P: Cellular and molecular biology of aquaporin water channels. Annu Rev Biochem 68: 425, 1999.
- deGroot BL, Grubmuller H: Waterpermeatie over biologische membranen: mechanisme en dynamiek van aquaporin-1 en GlpF. Wetenschap 294:2353, 2001.
- Hibuse T, Proc Nat Acad Sci (USA) 102: 10993, 2005.
- King LS, Agre P: Pathofysiology of the aquaporin water channels. Annu Rev Physiol 58: 619, 1998.
- Knepper MA, Inoue T: Regulation of aquaporin-2 water channel trafficking by vasopressine. Curr Opinion Cell Biol 9: 560, 1997.
- Lee MD, King LS, Agre P: The aquaporin family of water channel proteins in clinical medicine. Medicine 76: 141, 1997.
- Preston GM, Carroll TP, Guggino WP Agre P: Appearance of water channels in Xenopus oocytes expression red cell CHIP28 protein. Wetenschap 256: 385, 1992.
- Sasaki S, Ishibashi K, Marumo F: Aquaporin-2 en -3: vertegenwoordigers van twee subgroepen van de aquaporin familie colokalized in the kidney collecting duct. Annu Rev Physiol 60: 199, 1998.