Sir,
plaveiselcelcarcinomen (SCC) van de huid zijn vaak maligne huidtumoren, met een incidentie van 30 per 100.000 inwoners per jaar in West-Europa. In een zonniger klimaat komen ze nog vaker voor. SCC ontwikkelt zich gewoonlijk van actinische keratosen. Naast zonlicht, andere predisponerende factoren omvatten ioniserende straling, chronische ontsteking met littekens, virale infecties en immunosuppressie. Orgaantransplantatiepatiënten hebben vanwege hun immunosuppressieve therapie een aanzienlijk verhoogd risico, misschien wel 200 maal, op het ontwikkelen van SCC (1). Hetzelfde geldt voor patiënten met immunodeficiëntie als gevolg van andere factoren, bijvoorbeeld, die met HIV-infectie (1, 2).
CASE REPORT
een 50-jarige man had een grote tumor op zijn linkerwang, die zich in de afgelopen 3 maanden had ontwikkeld. De tumor had een verhoogde rand en een centraal gestanste maagzweer. Hij had zes maanden eerder in Tunesië gereisd met veel blootstelling aan de zon. Hoewel hij Fitzpatrick skin type II had, had hij nooit Zonbescherming geoefend. Klinisch onderzoek toonde geen verdere tekenen van actinische schade; in het bijzonder had hij geen actinische keratosen. Sinds zijn verblijf in Tunesië had de patiënt ook een chronische droge hoest. Zijn cervicale lymfeklieren waren normaal bij palpatie en met echografie onderzoek. Magnetic resonance tomography toonde geen infiltratie van aangrenzende weke delen structuren. Vanwege de snelle groei van de tumor en zijn macroscopisch uiterlijk, vermoedden we een keratoacanthoom. Histologisch onderzoek toonde een goed gedifferentieerd maar zweren SCC. Flow cytometrische analyse van perifere T-cellen toonde een onbalans aan, met slechts 5 CD4+ / CD3 + – cellen en 226 CD8+/CD3+ cellen (ratio 0,02), wat wijst op immunodeficiëntie en misschien de snelle groei van de tumor verklaart. Ondanks uitgebreide counseling over een mogelijk onderliggende immunosuppressieve ziekte, verwierp de patiënt verdere HIV diagnostische procedures, evenals aanvullende studies om de hoest (vermoedelijke Pneumocystis jiroveci pneumonie) te verduidelijken en uitzaaiingen uit te sluiten. Hij wees ook re-excisie met bredere marges af en verliet het ziekenhuis tegen medisch advies in.

Fig. 1. De linkerwang van een 50-jarige man met een grote tumor. a) dorsaal en B) zijdelings.
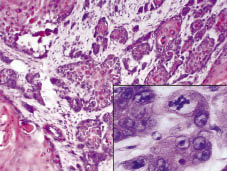
Fig. 2. Histologisch onderzoek toonde een diepe infiltrerende tumor aan, die de anatomische structuren vernietigde. Insert: de tumor bestaat uit polymorfe keratinocyten met verschillende mitoses (H&E ×200, met digitale vergroting).
discussie
Keratoacanthoma (KA) werd voor het eerst beschreven in 1889 door Jonathan Hutchinson als crateriform ulcus van het gezicht. Het komt het vaakst voor als een snel groeiende huidtumor op aan de zon blootgestelde gebieden (3). Mannen worden ongeveer 3 keer vaker getroffen dan vrouwen. De aangepaste leeftijdsverdeling laat zien dat deze het meest voorkomt op middelbare leeftijd en niet toeneemt in incidentie bij ouderen (in tegenstelling tot basaalcelcarcinoom en SCC) (4). Terwijl SCC zich van oppervlakteepitheel ontwikkelt, wordt KAs afgeleid van de haarfollikelmuur net boven waar het sebaceous kanaal ingaat. Zij zijn een afzonderlijke entiteit met specifieke klinische en histologische kenmerken (5). De neiging tot spontane regressie en de uitgebreide mate van keratinisatie zijn de meest opvallende kenmerken, samen met de typische symmetrische architectuur van de tumor (6).
De exacte nosologie en classificatie van KA staan ter discussie. Sommige auteurs beschouwen KA als een goedaardige huidtumor die het prototype is van de “pseudomalignante” tumoren van de huid, terwijl anderen beweren dat het een kwaadaardig neoplasma is – een eigenaardige variant van SCC – en daarom behandeld moet worden als SCC (7-9). De diagnostische problemen gelden vooral voor de destructieve, hardnekkige varianten van KA, zoals giant KA of mutilating KA. Klinisch is KA onderscheiden van SCC door zijn geschiedenis van snelle groei en zijn vulkaan-achtige vorm. In het hier beschreven geval vertoonde een groot SCC echter ook een zeer snelle groei, mogelijk als gevolg van HIV-infectie. Soms moeten laesies die als KAs worden beschouwd, opnieuw worden geclassificeerd als WCCV op basis van hun volgende klinische verloop. Naast een verkeerde diagnose, zijn andere verklaringen de combinatie van KA en SCC evenals de transformatie van KA naar SCC. Bovendien kunnen sommige KAs goed gedifferentieerde varianten van WCCV zijn, zoals voorgesteld door Ackerman (10-12).
vanwege de moeilijkheden om een onderscheid te maken tussen KA en SCC, is de voorkeursbehandeling voor alle soorten KAs nog steeds chirurgische excisie met histopathologische verificatie van de diagnose (8-10). Als chirurgie onmogelijk is, kan ioniserende straling worden overwogen. Verschillende andere therapeutische opties, zoals topische 5-fluorouracil, intra-lesionale injecties met interferon-alfa, methotrexaat of bleomycine en systemisch toegediende retinoïden, zijn in individuele gevallen effectief gebleken, maar er zijn geen gecontroleerde klinische studies die de efficiëntie van deze behandelingen aantonen (1, 4, 5).
sommige WCCV ‘ s kunnen snel groeien en een KA nabootsen, zoals in het hier beschreven geval. De reden voor de snelle groei van KAs is onduidelijk; er zijn verschillende hypothesen aangeboden, waaronder immunosuppressie en blootstelling aan overmatig zonlicht. KAs, vooral degenen die niet duidelijk van SCC kunnen worden onderscheiden, moeten door brede chirurgische excisie worden behandeld, aangezien zij een ongunstige prognose met vroege ontwikkeling van metastasen kunnen hebben.
1. Sterry W, Stockfleth E. Maligne epitheliale Tumore. In: Braun-Falco O, Plewig G, Wolff HH, Burgdorf WH, Landthaler M, editors. Dermatologie en Venerologie. 5th edn. Heidelberg: Springer, 2005: p. 1267-1276.
2. Nguyen P, Vin-Christian K, Ming ME, Berger T. agressieve plaveiselcelcarcinomen in personen besmet met de menselijke immunodeficiëntie virus. Arch Dermatol 2002; 138: 758–763.
3. Rinker MH, Fenske NA, Scalf LA, Glass LF. Histologische varianten van plaveiselcelcarcinoom van de huid. Cancer Control 2001; 8: 354-363.
4. Mac Kie RM, Quinn AG. Niet-melanoom huidkanker en epidermale huidtumoren. In: Burns T, Breathnack S, Cox N, Griffiths C, editors. Rook ‘ s leerboek dermatologie. 7e edn. Massachusetts: Blackwell Science, 2004: p. 43-46.
5. Kurschat P, Hess S, Hunzelmann N, Scharffetter-Kochanek K. Keratoacanthoma centrifugum marginatum vergezeld van extensive granulomatous foreign body reaction. Dermatol Online J 2005; 11: 16.
6. Bayer-Garner IB, Ivan D, Schwartz MR, Tschen JA. De immunopathologie van regressie in goedaardige lichenoid keratosis, keratoacanthoma en halo nevus. Clin Med Res 2004; 2: 89-97.
7. Cribier B, Asch P, Grosshans E. differentiatie van plaveiselcelcarcinoom van keratoacanthoom met behulp van histopathologische criteria. Is het mogelijk? Een studie van 296 gevallen. Dermatologie 1999; 199: 208-212.
8. Beham a, Regauer S, Soyer HP, Beham-Schmid C. Keratoacanthoma: een klinisch verschillende variant van goed gedifferentieerd plaveiselcelcarcinoom. Adv Anat Pathol 199; 5: 269-280.
9. Warner DM, Flowers F, Ramos-Caro FA. Solitair keratoacanthoom (plaveiselcelcarcinoom): chirurgische behandeling. Int J Dermatol 1995; 34: 17-19.
10. Hodak E, Jones RE, Ackerman AB. Solitair keratoacanthoma is een plaveiselcelcarcinoom: drie voorbeelden met metastasen. Am J Dermatopathol 1993; 15: 332-342.
11. Sanchez YE, Simon P, Requena L, Ambrojo P, De Eusebio E. Solitary keratoacanthoma: a self-healing proliferation that frequently becomes maligne. Am J Dermatopathol 2000; 22: 305-310.
12. Lawrence N, Reed RJ. Actinische keratoacanthoom. Speculaties over de aard van de laesie en de rol van cellulaire immuniteit in zijn evolutie. Am J Dermatopathol 1990; 12: 517-533.