Generic Name: epinastine hydrochloride
Dosage Form: ophthalmic solution
Medically reviewed by Drugs.com. Last updated on June 1, 2020.
- Overview
- Side Effects
- Dosage
- Professional
- Pregnancy
- More
Indications and Usage for Epinastine HCl Ophthalmic Solution
Epinastine HCl Ophthalmic Solution 0.05% is geïndiceerd voor de preventie van jeuk geassocieerd met allergische conjunctivitis.
Epinastine HCl oftalmische oplossing dosering en toediening
De aanbevolen dosering is tweemaal daags één druppel in elk oog.
De behandeling moet worden voortgezet gedurende de gehele blootstellingsperiode (d.w.z. totdat het pollenseizoen voorbij is of totdat de blootstelling aan het gewraakte allergeen is beëindigd), zelfs wanneer de symptomen afwezig zijn.
doseringsvormen en sterktes
oplossing die 0 bevat.5 mg/mL epinastine HCl
Contra-indicaties
Geen
Waarschuwingen en Voorzorgsmaatregelen
Verontreiniging van de Tip en de Oplossing
Patiënten moeten worden geïnstrueerd om te voorkomen dat de punt van de dispenser container contact met de ogen, de omliggende structuren, vingers, of een andere ondergrond om te voorkomen dat besmetting van de oplossing van gemeenschappelijke bacteriën bekend om het veroorzaken van oculaire infecties. Ernstige schade aan het oog en verlies van het gezichtsvermogen kan het gevolg zijn van het gebruik van verontreinigde oplossingen.
fles dient zorgvuldig gesloten te worden gehouden wanneer deze niet in gebruik is.
gebruik met contactlenzen
patiënten moet worden geadviseerd geen contactlens te dragen als hun oog rood is. Epinastine HCl oftalmische oplossing 0,05% mag niet worden gebruikt voor de behandeling van contactlensgerelateerde irritatie.
het conserveermiddel in Epinastine HCl oftalmische oplossing 0,05%, benzalkoniumchloride, kan worden geabsorbeerd door zachte contactlenzen. Contactlenzen moeten worden verwijderd voordat Epinastine HCl oftalmische oplossing 0,05% wordt toegediend en kunnen na 10 minuten na toediening opnieuw worden ingebracht.
topisch oftalmisch gebruik alleen
Epinastine HCl oogoplossing 0.05% is alleen voor topisch oftalmisch gebruik en niet voor injectie of oraal gebruik.
bijwerkingen
klinische Studies ervaring
omdat klinische studies onder zeer uiteenlopende omstandigheden worden uitgevoerd, kunnen de percentages bijwerkingen die in de klinische studies van een geneesmiddel zijn waargenomen, niet direct worden vergeleken met de percentages in de klinische studies van een ander geneesmiddel en weerspiegelen zij mogelijk niet de percentages die in de praktijk zijn waargenomen.
de meest frequent gemelde oculaire bijwerkingen die optraden bij ongeveer 1-10% van de patiënten waren een brandend gevoel in het oog, folliculose, hyperemie en pruritus.
De vaakst gemelde niet-oculaire bijwerkingen waren infecties (verkoudheidssymptomen en infecties van de bovenste luchtwegen), waargenomen bij ongeveer 10% van de patiënten, en hoofdpijn, rhinitis, sinusitis, toegenomen hoest en faryngitis, waargenomen bij ongeveer 1 – 3% van de patiënten.
sommige van deze reacties waren vergelijkbaar met de onderliggende ziekte die werd onderzocht.
Postmarketing ervaring
de volgende reacties zijn vastgesteld tijdens postmarketing gebruik van Epinastine HCl oftalmische oplossing 0,05% in de klinische praktijk. Omdat ze vrijwillig worden gemeld bij een populatie van onbekende omvang, kunnen geen schattingen van de frequentie worden gemaakt. De reacties, die zijn gekozen voor inclusie vanwege hun ernst, frequentie van rapportage, mogelijk causaal verband met Epinastine HCl oftalmische oplossing 0,05%, of een combinatie van deze factoren, omvatten: verhoogde traanafscheiding.
gebruik in specifieke populaties
zwangerschap
teratogene effecten
zwangerschapscategorie C
in een embryofoetale ontwikkelingsstudie bij drachtige ratten werd maternale toxiciteit zonder embryofoetale effecten waargenomen bij een orale dosis die ongeveer 150.000 keer de maximale aanbevolen oculaire humane dosis (mrohd) van 0,0014 mg/kg/dag op basis van mg / kg was. Totale resorpties en abortus werden waargenomen in een embryofoetale studie bij zwangere konijnen bij een orale dosis die ongeveer 55.000 keer de MROHD was. In beide studies werden geen geneesmiddelgeïnduceerde teratogene effecten waargenomen.
Epinastine verminderde de gewichtstoename van de jongen na een orale dosis aan zwangere ratten die ongeveer 90.000 keer de MROHD was.
er zijn echter geen adequate en goed gecontroleerde onderzoeken bij zwangere vrouwen. Omdat reproductiestudies bij dieren niet altijd voorspellend zijn voor de respons bij de mens, mag Epinastine HCl oftalmische oplossing 0,05% tijdens de zwangerschap alleen worden gebruikt als het potentiële voordeel het potentiële risico voor de foetus rechtvaardigt.
moeders die borstvoeding geven
een onderzoek bij zogende ratten toonde uitscheiding van epinastine in de moedermelk aan. Het is niet bekend of dit medicijn wordt uitgescheiden in de moedermelk. Omdat veel drugs worden uitgescheiden in de moedermelk, moet voorzichtigheid worden betracht wanneer Epinastine HCl oftalmische oplossing 0,05% wordt toegediend aan een zogende vrouw.
gebruik bij kinderen
veiligheid en werkzaamheid bij kinderen jonger dan 2 jaar zijn niet vastgesteld.
geriatrisch gebruik
Er zijn geen algemene verschillen in veiligheid of werkzaamheid waargenomen tussen oudere en jongere patiënten.
Epinastine HCl oftalmische oplossing beschrijving
Epinastine HCl oftalmische oplossing 0.05% is a clear, colorless, sterile isotonic solution containing epinastine HCl, an antihistamine and an inhibitor of histamine release from the mast cell for topical administration to the eyes.
Epinastine HCl is represented by the following structural formula:
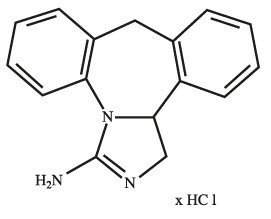
C16H15N3HCl Mol. Wt. 285.78
Chemical Name:
3-Amino-9,13b-dihydro-1H-dibenzimidazoazepine hydrochloride
Each mL contains: Active: Epinastine HCl 0.05% (0.5 mg/mL) equivalent to epinastine 0.044% (0.44 mg/mL); Preservative: Benzalkonium chloride 0.01%; Inactives: Dinatriumedetaat-dihydraat; gezuiverd water; natriumchloride; monobasisch, watervrij natriumfosfaat en natriumhydroxide en / of zoutzuur (voor het aanpassen van de pH).
Epinastine HCl oftalmische oplossing 0,05% heeft een pH van ongeveer 7 en een osmolaliteitsbereik van 250 tot 310 mOsm / kg.
Epinastine HCl oftalmische oplossing-Klinische Farmacologie
werkingsmechanisme
Epinastine is een topisch actieve, directe H1-receptorantagonist en een remmer van de afgifte van histamine uit de mestcel. Epinastine is selectief voor de histamine H1-receptor en heeft affiniteit voor de histamine H2-receptor. Epinastine bezit ook affiniteit voor de α1-, α2-en 5–HT2-receptoren.
farmacokinetiek
veertien proefpersonen met allergische conjunctivitis kregen gedurende 7 dagen tweemaal daags één druppel Epinastine HCl oftalmische oplossing 0,05% in elk oog. Op dag 7 werden gemiddelde maximale epinastineplasmaconcentraties van 0,04±0,014 ng/ml bereikt na ongeveer twee uur, wat wijst op een lage systemische blootstelling. Hoewel deze concentraties een toename vertegenwoordigden ten opzichte van de concentraties die na een enkele dosis werden waargenomen, waren de waarden van Dag 1 en dag 7 Area Under The Curve (AUC) onveranderd, wat erop wijst dat er geen toename is in systemische absorptie bij meervoudige toediening. Epinastine is voor 64% gebonden aan plasma-eiwitten. De totale systemische klaring is ongeveer 56 L / uur en de terminale plasma eliminatiehalfwaardetijd is ongeveer 12 uur. Epinastine wordt voornamelijk onveranderd uitgescheiden. Ongeveer 55% van een intraveneuze dosis wordt onveranderd teruggevonden in de urine met ongeveer 30% in de ontlasting. Minder dan 10% wordt gemetaboliseerd. De renale eliminatie vindt voornamelijk plaats via actieve tubulaire secretie.
niet-klinische Toxicologie
carcinogenese, mutagenese, verminderde vruchtbaarheid
in 18 maanden of 2 jaar durende carcinogeniciteitsstudies in de voeding bij respectievelijk muizen en ratten was epinastine niet carcinogeen bij doses tot 40 mg / kg .
Epinastine in nieuw gesynthetiseerde partijen was negatief voor mutageniciteit in de Ames/Salmonella-test en in vitro chromosoomaberratietest met humane lymfocyten. Positieve resultaten werden gezien met vroege partijen epinastine in twee in vitro chromosomale aberratiestudies die in de jaren 1980 werden uitgevoerd met respectievelijk humane perifere lymfocyten en met V79-cellen. Epinastine was negatief in de in vivo clastogeniciteitsstudies, waaronder de micronucleustest bij muizen en de chromosoomafwijktest bij Chinese hamsters. Epinastine was ook negatief in de celtransformatietest met embryocellen van Syrische hamsters, V79/HGPRT-mutatietest met zoogdiercelpunten en in vivo/in vitro niet-geplande DNA-synthesetest met primaire hepatocyten van ratten.
Epinastine had geen effect op de vruchtbaarheid van mannelijke ratten. Verminderde vruchtbaarheid bij vrouwtjesratten werd waargenomen bij een orale dosis tot ongeveer 90.000 maal de MROHD.
klinische Studies
Epinastine HCl 0,05% is significant superieur aan vehiculum voor het verbeteren van oculaire jeuk bij patiënten met allergische conjunctivitis in klinische studies waarbij twee verschillende modellen werden gebruikt: (1) conjunctival antigen challenge (CAC) waarbij patiënten werden gedoseerd en vervolgens antigeen kregen toegediend in de inferieure conjunctivale fornix; en (2) milieu veldstudies waarbij patiënten werden gedoseerd en geëvalueerd tijdens het allergieseizoen in hun natuurlijke habitat. De resultaten toonden een snelle aanvang van werking voor epinastine HCl 0,05% binnen 3 tot 5 minuten na conjunctivale antigeenuitdaging aan. De duur van het effect bleek 8 uur te zijn, wat een tweemaal daags regime geschikt maakt. Dit doseringsschema bleek veilig en effectief te zijn gedurende maximaal 8 weken, zonder bewijs van tachyfylaxe.
hoe geleverd/opslag en hantering
Epinastine HCl oftalmische oplossing 0.05% wordt steriel geleverd in dekkend wit LDPE plastic flesjes met pipet tips en wit polypropyleen (PP) caps is als volgt:
| 5 mL in 10 mL fles | NDC 51991-836-75 |
Opslag: Bewaren bij 20° – 25°C (68° – 77°F) . De fles zorgvuldig gesloten en buiten het bereik van kinderen houden.
Patiëntbegeleiding informatie
steriliteit van de druppeltip
patiënten dient te worden geadviseerd de druppeltip niet aan te raken op enig oppervlak, omdat dit de inhoud kan verontreinigen (zie wanneer moet u extra voorzichtig zijn met dit middel? 5.1).
gelijktijdig gebruik van contactlenzen
patiënten dient te worden geadviseerd geen contactlenzen te dragen als hun oog rood is. Patiënten dienen te worden geïnformeerd dat Epinastine HCl oftalmische oplossing 0,05% niet mag worden gebruikt voor de behandeling van contactlensgerelateerde irritatie. Patiënten moet ook worden geadviseerd om contactlenzen te verwijderen voordat Epinastine HCl oftalmische oplossing 0,05% wordt toegediend.
het conserveermiddel in Epinastine HCl oftalmische oplossing 0,05%, benzalkoniumchloride, kan worden geabsorbeerd door zachte contactlenzen. Lenzen mogen na 10 minuten na toediening van Epinastine HCl oftalmische oplossing 0,05%
topisch oftalmisch gebruik
alleen voor topisch oftalmisch gebruik.
RX alleen
verdeeld door:
Breckenridge Pharmaceutical, Inc.
Berlin, CT 06037
vervaardigd door:
PrimaPharma, Inc.
San Diego, CA 92121
Rev: 04/2020
2323 04/20
PRINCIPAL DISPLAY PANEL – 5 mL Bottle Carton
NDC 51991-836-75
Epinastine HCl
Ophthalmic
Solution,
0.05%
FOR USE IN THE
EYES ONLY
sterile
Rx Only
5 mL sterile
breckenridge
A Towa
Company

| EPINASTINE HYDROCHLORIDE epinastine hydrochloride solution/ drops |
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
Labeler – Breckenridge Pharmaceutical, Inc. (150554335)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| PrimaPharma, Inc. | 079699106 | MANUFACTURE(51991-836) | |
More about epinastine oftalmic
- bijwerkingen
- Tijdens zwangerschap of borstvoeding
- doseringsinformatie
- prijs & Coupons
- in het Engels
- 3 recensies
- Drug class: oftalmische antihistaminica en decongestiva
consumentenbronnen
- patiënteninformatie
- Epinastine oftalmisch (Gevorderde lezing)
professionele bronnen
- voorschrijfinformatie
- Epinastine (professioneel Patiëntenadvies)
andere merken Elestat
- conjunctivitis, allergische
medische Disclaimer